题目内容
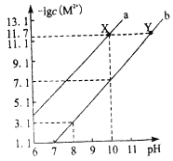
【题目】溶液 X中可能含有如下离子:Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
A.取溶液X进行焰色反应,火焰呈黄色。说明溶液不含K+
B.取固体Y加入过量的稀盐酸,沉淀部分溶解。说明溶液X含![]() 、不含
、不含![]()
C.取滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。说明溶液X中含Cl-
D.取滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。说明溶液X中含![]()
【答案】D
【解析】
A. 溶液X焰色反应呈黄色,说明有Na+但不能说明溶液不含K+,因为黄色会掩盖住紫色,应该透过蓝色钴玻璃,如果没看到紫色才能说明不含K+,A错误;
B. 固体Y加入过量的稀盐酸,沉淀部分溶解,则沉淀为BaSO4和BaCO3的混合物,说明溶液X含![]() 、
、![]() ,B错误;
,B错误;
C. 滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。只能说明滤液Z中有Cl-而不能说明溶液X中含Cl-,因为加入的过量BaCl2引入了Cl-,造成干扰,C错误;
D. 滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝,说明生成了NH3,说明滤液Z、溶液X中都含![]() ,D正确;
,D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
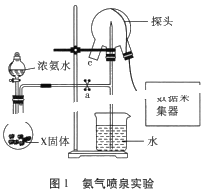
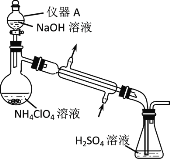
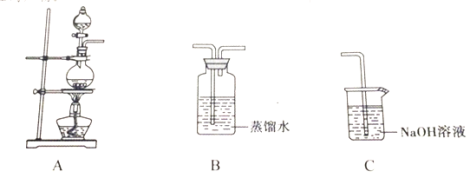
小学生10分钟应用题系列答案【题目】实验小组以二氧化锰和浓盐酸为反应物,连接装置A→B→C制取氯水,并探究氯气和水反应的产物。
(1)A中发生反应的离子方程式是_________。
(2)B中得到浅黄绿色的饱和氯水,将所得氯水分三等份,进行的操作、现象、结论如下:
实验 | 实验操作 | 现象 | 结论 |
Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
(1)甲同学指出:由实验Ⅰ得出的结论不合理,原因是制取的氯水中含有杂质______(填化学式),也能与碳酸氢钠反应产生气泡。应在A、B间连接除杂装置,请画出除杂装置并标出气体流向和药品名称______。
(2)乙同学指出由实验Ⅱ得出的结论不合理,原因是实验未证明_______(填化学式)是否有漂白性。
(3)丙同学利用正确的实验装置发现氯水中有Cl-存在,证明氯水中有Cl-的操作和现象是:_____。丙同学认为,依据上述现象和守恒规律,能推测出氯水中有次氯酸存在。这一推测是否正确,请说明理由________。
(4)丁同学利用正确的实验装置和操作进行实验,观察到实验现象与实验Ⅰ、Ⅱ相似,说明氯气和水反应的产物具有的性质是________。
(5)戊同学将第三份氯水分成两等份,向其中一份加入等体积的蒸馏水,溶液接近无色。另一份中加入等体积饱和的氯化钠溶液,溶液为浅黄绿色。对比这两个实验现象能说明:_______。
【题目】相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
2SO3(g) △H=-197 kJ/mol ,实验测得有关数据如下:
容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/kJ | ||
SO2 | O2 | SO3 | ||
甲 | 2 | 1 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中正确的是
A.两容器中反应的平衡常数不相等
B.达到平衡时SO2的体积分数:甲<乙
C.197>Q1>Q2
D.生成1molSO3(l)时放出的热量等于98.5kJ