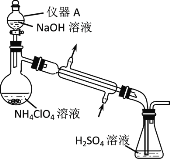
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΦΉΓΔ““ΓΔ±ϊ3Ηω…’±≠÷–Ζ÷±πΉΑ”–œΓH2SO4ΓΔCuCl2»ή“ΚΓΔ±ΞΚΆ ≥―ΈΥ°Θ§ΦΉ÷–ΒγΦΪΈΣ–ΩΤ§ΚΆΆ≠Τ§Θ§““÷–ΒγΦΪΈΣ ·ΡΪΑτC1ΓΔC2Θ§±ϊ÷–ΒγΦΪΈΣ ·ΡΪΑτC3ΓΔΧζΤ§Θ§ΒγΦΪ÷°Φδ”ΟΒΦœΏœύΝ§ΓΘ‘ρœ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «
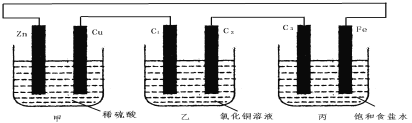
A.ΦΉ «Μ·―ßΡήΉΣ±δΈΣΒγΡήΘ§““ΓΔ±ϊ «ΒγΡήΉΣ±δΈΣΜ·―ßΡή
B.C1ΓΔC2Ζ÷±π «―τΦΪΓΔ“θΦΪΘ§–ΩΤ§ΓΔC3…œΕΦΖΔ…ζ―θΜ·Ζ¥”Π
C.C1ΚΆC3Ζ≈≥ωΒΡΤχΧεœύΆ§Θ§Ά≠Τ§ΚΆΧζΤ§Ζ≈≥ωΒΡΤχΧε“≤œύΆ§
D.ΦΉ÷–»ή“ΚΒΡpH÷πΫΞ…ΐΗΏΘ§““ΓΔ±ϊ÷–»ή“ΚΒΡpH÷πΫΞΦθ–Γ
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ
A. ΦΉ÷––ΩΤ§ΚΆΆ≠Τ§ΓΔœΓΝρΥαΙΙ≥…‘≠Βγ≥ΊΘ§‘ρ““ΓΔ±ϊΈΣΒγΫβ≥ΊΘ§Υυ“‘ΦΉ «Μ·―ßΡήΉΣ±δΈΣΒγΡήΘ§““ΓΔ±ϊ «ΒγΡήΉΣ±δΈΣΜ·―ßΡήΘ§A’ΐ»ΖΘΜ
B. ΦΉ÷––ΩΤ§ΚΆΆ≠Τ§ΓΔœΓΝρΥαΙΙ≥…‘≠Βγ≥ΊΘ§ΜνΤΟΫπ τ–ΩΈΣΗΚΦΪΖΔ…ζ―θΜ·Ζ¥”ΠΘ§Ά≠ΈΣ’ΐΦΪΘ§Υυ“‘C1ΓΔC2Ζ÷±π «―τΦΪΓΔ“θΦΪΘ§C3 «―τΦΪΖΔ…ζ―θΜ·Ζ¥”ΠΘ§B’ΐ»ΖΘΜ
C. ”…BΒΡΖ÷ΈωΘ§C1ΓΔC3ΕΦ «―τΦΪΘ§ΕΦΈΣCl- ßΒγΉ”Ζ≈≥ωCl2Θ§Ά≠Τ§ΈΣ’ΐΦΪΘ§H+ΒΟΒΫΒγΉ”Ζ≈≥ωH2ΓΔΧζΒγΦΪΈΣ“θΦΪΘ§»ή“Κ÷–ΒΡH+ΒΟΒΫΒγΉ”Ζ≈≥ωH2Θ§C’ΐ»ΖΘΜ
D. ΦΉ÷––ΩΤ§ΚΆΆ≠Τ§ΓΔœΓΝρΥαΙΙ≥…‘≠Βγ≥ΊΘ§H+ΒΟΒΫΒγΉ”Ζ≈≥ωH2Θ§»ή“ΚΒΡpH÷πΫΞ…ΐΗΏΘΜ““ΒγΦΪΒγΫβ÷ CuCl2±Ψ…μΘ§pHΜυ±Ψ≤Μ±δΘΜ±ϊΒγΦΪ±ΞΚΆ¬»Μ·ΡΤ»ή“Κ…ζ≥…NaOHΘ§»ή“ΚΒΡpH÷πΫΞ…ΐΗΏΘ§D¥μΈσΘΜ
Ι Κœάμ―Γœν «DΓΘ

ΓΨΧβΡΩΓΩ““ΕΰΥαΥΉ≥Τ≤ίΥαΘ®ΫαΙΙΦρ ΫΈΣHOOCΓΣCOOHΘ§Ω…Φρ–¥ΈΣH2C2O4Θ©Θ§Υϋ «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΓΘΘ®≥ΘΈ¬œ¬0.01 mol/LΒΡH2C2O4ΓΔKHC2O4ΓΔK2C2O4»ή“ΚΒΡpH»γ±μΥυ ΨΓΘΘ©ΧνΩ’ΘΚ
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)–¥≥ωH2C2O4ΒΡΒγάκΖΫ≥Χ Ϋ________________ΓΘ
(2)KHC2O4»ή“Κœ‘Υα–‘ΒΡ‘≠“ρ «_________________ΘΜœρ0.1 mol/LΒΡ≤ίΥα«βΦΊ»ή“ΚάοΒΈΦ”NaOH»ή“Κ÷Ν÷––‘Θ§¥Υ ±»ή“ΚάοΗςΝΘΉ”≈®Ε»ΙΊœΒ’ΐ»ΖΒΡ «______ΓΘ
aΘ°c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) bΘ°c(Na+)=c(H2C2O4)+c(C2O42-)
cΘ°c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) dΘ°c(K+)>c(Na+)
(3)H2C2O4”κΥα–‘ΗΏΟΧΥαΦΊ»ή“ΚΖ¥”ΠΘ§œ÷œσ «”–Τχ≈ί(CO2)≤ζ…ζΘ§Ήœ…Ϊœϊ ßΓΘ–¥≥ωΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ____________________ΘΜ”÷÷ΣΗΟΖ¥”ΠΩΣ Φ ±ΥΌ¬ Ϋœ¬ΐΘ§ΥφΚσ¥σ¥σΦ”ΩλΘ§Ω…ΡήΒΡ‘≠“ρ «______________________ΓΘ
ΓΨΧβΡΩΓΩœύΆ§Έ¬Ε»œ¬Θ§»ίΜΐœύΆ§ΒΡΦΉΓΔ““ΝΫΗωΚψ»ίΟή±’»ίΤς÷–ΨυΖΔ…ζ»γœ¬Ζ¥”ΠΘΚ2SO2(g)+O2(g) ![]() 2SO3(g) ΓςH=-197 kJ/mol Θ§ Β―ι≤βΒΟ”–ΙΊ ΐΨί»γœ¬ΘΚ
2SO3(g) ΓςH=-197 kJ/mol Θ§ Β―ι≤βΒΟ”–ΙΊ ΐΨί»γœ¬ΘΚ
»ίΤς±ύΚ≈ | Τπ Φ ±ΗςΈο÷ ΒΡΈο÷ ΒΡΝΩ / mol | ¥οΒΫΤΫΚβ ±ΧεœΒΡήΝΩΒΡ±δΜ·/kJ | ||
SO2 | O2 | SO3 | ||
ΦΉ | 2 | 1 | 0 | Ζ≈≥ω»»ΝΩΘΚQ1 |
““ | 1.8 | 0.9 | 0.2 | Ζ≈≥ω»»ΝΩΘΚQ2 |
œ¬Ν–≈–Εœ÷–’ΐ»ΖΒΡ «
A.ΝΫ»ίΤς÷–Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ≤ΜœύΒ»
B.¥οΒΫΤΫΚβ ±SO2ΒΡΧεΜΐΖ÷ ΐΘΚΦΉ<““
C.197>Q1>Q2
D.…ζ≥…1molSO3(l) ±Ζ≈≥ωΒΡ»»ΝΩΒ»”Ύ98.5kJ