题目内容
【题目】把铝粉和某铁的氧化物(xFeO·yFe2O3)粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为
A.1∶1B.1∶2C.5∶7D.7∶5
【答案】B
【解析】
第一份中Al与xFeOyFe2O3粉末得到Fe与Al2O3,再与足量盐酸反应,发生反应:Fe+2HCl=FeCl2+H2↑,第二份直接放入足量的烧碱溶液,发生反应:2Al+2NaOH+2H2O=NaAlO2+3H2↑,前后两种情况下生成的气体质量比是5:7,则令第一份、第二份生成氢气物质的量分别为5mol、7mol,根据方程式计算Fe、Al的物质的量,再根据第一份中Al与xFeOyFe2O3反应的电子转移守恒计算xFeOyFe2O3中Fe元素平均化合价,进而计算x、y比例关系。
第一份中Al与xFeOyFe2O3粉末得到Fe与Al2O3,再与足量盐酸反应,发生反应:Fe+2HCl=FeCl2+H2↑,第二份直接放入足量的烧碱溶液,发生反应:2Al+2NaOH+2H2O=NaAlO2+3H2↑,前后两种情况下生成的气体质量比是5:7,令第一份、第二份生成氢气物质的量分别为5mol、7mol,则:
![]()
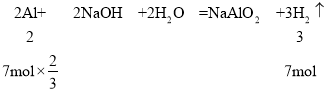
令xFeOyFe2O3中Fe元素平均化合价为a,根据Al与xFeOyFe2O3反应中的电子转移守恒:7mol×![]() ×3=5mol×(a0),解得a=2.8,故
×3=5mol×(a0),解得a=2.8,故![]() =2.8,整理得x:y=1:2,答案选B。
=2.8,整理得x:y=1:2,答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目