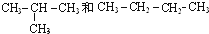题目内容
16.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程: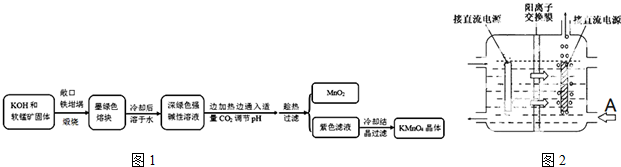
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
分析 以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体,软锰矿固体和KOH固体混合在铁坩埚中煅烧,得到墨绿色熔块,为锰酸钾,冷却后溶于水其水溶液呈深绿色,这是锰酸根(MnO42-)在碱溶液中的特征颜色,边加热边通入适量二氧化碳气体,调节溶液PH趁热过滤得到二氧化锰固体和高锰酸钾溶液,冷却结晶得到高锰酸钾晶体;
(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,用铁坩埚煅烧暴露在空气中的固体混合物,二氧化锰、氢氧化钾、氧气发生反应生成锰酸钾和水;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4;氧化还原反应中氧化剂是元素化合价降低的物质,还原剂是元素化合价升高的物质,结合化学方程式定量关系和电子守恒计算;
(3)分析盐酸具有还原性容易被高锰酸钾氧化,使产品变质,硫酸反应生成的硫酸钾溶解度小,会随高锰酸钾晶体析出;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区.
解答 解:(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀,加热软锰矿和KOH固体时,不采用瓷坩埚而选用铁坩埚;用铁坩埚煅烧暴露在空气中的固体混合物加热条件下,二氧化锰、氢氧化钾和氧气反应生成锰酸钾和水,反应方程式为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(2)工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,实验中通入适量CO2时体系中可能发生反应离子方程式为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O,其中氧化还原反应中氧化剂和还原剂都是高锰酸钾,所以氧化剂和还原剂的质量比即为反应的物质的量之比为1:2;
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;1:2;
(3)因为盐酸具有还原性,易被高锰酸钾氧化,醋酸钾的溶解度比硫酸钾大的多,蒸发浓缩时基本上都会留在母液中,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出得到的高锰酸钾中含有杂质;
故答案为:A;
(4)惰性电极电解锰酸钾溶液制取高锰酸钾,锰酸根离子在阳极失电子生成高锰酸根离子,溶液中氢离子在阴极得到电子生成氢气,溶液中氢氧根离子浓度增大生成碱,电解反应的化学方程式为:2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH,阳离子交换膜分隔两极区进行电解锰酸钾溶液制取高锰酸钾,阳离子移向方向可知左边电极为阳极,右边冒气泡的电极为阴极,为维持电解质溶液电荷守恒,A处最好加入氢氧化钾溶液,使用阳离子交换膜可以提高Mn元素利用率是因为阳离子交换膜防止锰酸根进入阴极区被还原;
故答案为:2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).
(5)A与D形成的化合物A2D2是共价化合物(填共价或离子),其电子式为
 .
. | A. | 丙炔 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
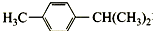 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:4:1:3:3 | B. | 3:2:2:1:6 | C. | 9:4:1 | D. | 3:4:7 |
 .
.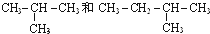 I.
I.