题目内容
1.金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.(1)Ca元素在周期表中位置是第四周期第ⅡA族,其原子结构示意图
 .
.(2)Ca与最活泼的非金属元素A形成化合物D,D的沸点比A与Mg形成的化合物E的沸点低(填“高”或“低”).
(3)配平用钙线氧脱鳞的化学方程式:
2P+5FeO+3CaO$\frac{\underline{\;高温\;}}{\;}$1Ca3(PO4)2+5Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为Fe;用化学方程式解释颜色变化FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3
检测Mn+的方法是Fe+3SCN-=Fe(SCN)3(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反应,生成224mL H2(标准状况),在溶液中通入适量的CO2,最多能得到CaCO31.1g.
分析 (1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,对于主族元素,电子层数=周期数,最外层电子数=族序数;
(2)最活泼的非金属元素A为F,则Ca与最活泼的非金属元素F形成化合物D为CaF2,A与Mg形成的化合物E为MgF2,都为离子晶体,根据离子晶体判断沸点高低;
(3)根据得失电子数相等配平方程式;
(4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,利用Fe3+与SCN-结合生成红色物质检验铁离子;
(5)钙与水反应生成氢氧化钙与氢气,根据n=$\frac{V}{V{\;}_{m}}$计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量.
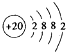
解答 解:(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,其原子结构示意图为 ,
,
故答案为:第四周期第ⅡA族; .
.
(2)最活泼的非金属元素A为F,则Ca与最活泼的非金属元素F形成化合物D为CaF2,A与Mg形成的化合物E为MgF2,因为钙离子半径比镁离子半径大,MgF2的晶格能比CaF2大,所以D的沸点比E低,
故答案为:低;
(3)该方程式中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;
FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为:2P+5FeO+3CaO$\frac{\underline{\;高温\;}}{\;}$Ca3(PO4)2+5Fe
故答案为:2;5;3;1;5;
(4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,发生的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe;FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe3++3SCN-=Fe(SCN)3;
(5)224mLH2的物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为$\frac{0.01mol×2}{2}$=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为$\frac{0.056g}{56g/mol}$=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g,
故答案为:1.1.
点评 本题考查结构与位置关系、常用化学用语书写、氧化还原反应、化学计算等,题目综合性较大,难度中等,(5)中注意利用守恒进行计算.

| A. | 氯化氢分子的电子式: | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
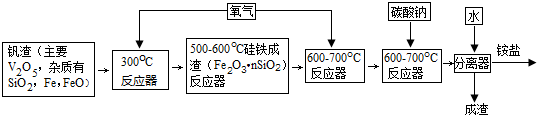
(1)V2O5与氢氧化钠反应的离子方程式:V2O5+6OH-=2VO43-+3H2O.
(2)300℃反应器主要目的是把铁氧化为四氧化三铁.
(3)600-700℃反应器通入氧气的目的是把四氧化三铁氧化为氧化铁.
(4)加入铵盐后,通过过滤、洗涤和干燥得到纯净的“黄饼”(NH4)6V10O28•nH2O.洗涤“黄饼”选用合适的试剂是C.
A.1%的氨水 B.1%的铵盐 C.5%的酒精 D.蒸馏水
(5)①“黄饼”(NH4)6V10O28•nH2O含“结晶水”占质量的20.21%,则n为15.
②对上述“黄饼”133.6g进行热重分析:
| 温度K | 293 | 373 | 773 |
| 质量(g) | 133.6 | 106.6 | 91.0 |
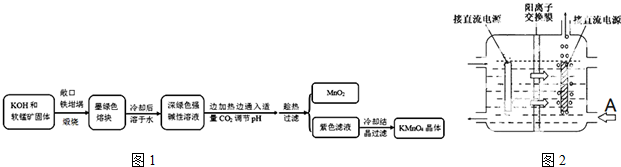
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
| A. | 聚乙炔是乙炔发生聚合反应形成的高聚物 | |
| B. | 聚乙炔的化学式为 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 聚乙炔不可能发生加成反应 |
| A. | 把块状固体反应物研成粉末 | B. | 使用合适的催化剂 | ||
| C. | 增加反应物的浓度 | D. | 改变反应的温度 |
| A. | 它们互为同分异构体 | B. | 沸点较高的是甲酸乙酯 | ||
| C. | 它们可用红外光谱法鉴别 | D. | 它们可用KMnO4(H+)溶液鉴别 |
| A. | 戊酸丁酯 | B. | 葡萄糖 | C. | 丙酸丙酯 | D. | 甲酸乙酯 |