题目内容
1.0.1 mol•L-1的CH3COONH4溶液显中性,下列关于该溶液的说法正确的是 ( )| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
分析 A、醋酸铵中醋酸根离子和铵根离子均会发生水解;
B、醋酸铵中醋酸根离子和铵根离子均会发生水解,均对水的电离起到促进作用;
C、0.1 mol•L-1的CH3COONH4溶液显中性,说明醋酸根离子水解程度和铵根离子的水解程度相当;
D、根据醋酸铵中铵根离子和醋酸根离子的水解以及物料守恒来回答.
解答 解:A、醋酸铵中醋酸根离子和铵根离子均会发生水解,所以该溶液中:c(CH3COO-)=c(NH4+),小于0.1 mol•L-1,故A错误;
B、醋酸铵中醋酸根离子和铵根离子均会发生水解,均对水的电离起到促进作用,水解程度相等,CH3COO-+H20?CH3C00H+OH-,NH4++H20?NH3•H20+H+,所以c(CH3C00H)=c(NH3•H20)<c(H+)=c(OH- ),故B错误;
C、0.1 mol•L-1的CH3COONH4溶液显中性,说明醋酸根离子水解程度和铵根离子的水解程度相当,c(CH3C00H)=c(NH3•H20),c(H+)=c(OH- ),所以c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+),故C正确;
D、根据醋酸铵中铵根离子和醋酸根离子均会水解,CH3COO-+H20?CH3C00H+OH-,NH4++H20?NH3•H20+H+,根据物料守恒c(CH3COO-)+c(CH3C00H)=0.1mol/L,c(NH3.H20)+c(NH4+)=0.1mol/L,所以c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.1mol•L-1,故D错误.
故选C.
点评 本题涉及溶液中离子浓度之间的关系以及盐的水解规律以及应用等知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
12.下列金属元素中,不属于碱金属元素的是( )
| A. | Li | B. | Na | C. | Rb | D. | Mg |
16.医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有较丰富的( )
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
6.下列表达方式错误的是( )
| A. | 氯化氢分子的电子式: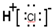 | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
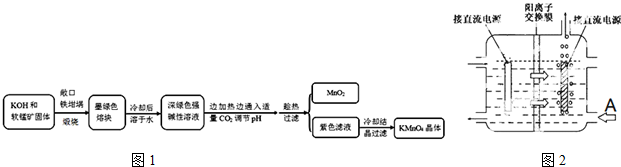
16.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;高温\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.