题目内容
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
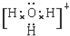 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是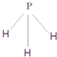 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
分析 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.T原子所处的周期数、族序数分别与其原子序数相等,则T的原子序数为1,T为H元素;X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则核外电子排布为1s22s22p2,故X为C元素;R元素原子3p能级上有1个电子,外围电子排布为3s23p1,故R为Al元素;Z的基态原子价电子排布为ns2npn+2,结合原子序数可知,Z处于第二周期,即n=2,则Z为O元素;Y的原子序数介于碳元素、氧元素之间,则Y为N元素;Q的原子序数大于氧元素小于Al元素,在该元素所在周期中,Q的基态原子的第一电离能最小,故Q处于第三周期,为Na元素;W的一种核素的质量数为65,中子数为36,质子数为65-36=29,故W为Cu元素,由此分析解答.
解答 解:T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.T原子所处的周期数、族序数分别与其原子序数相等,则T的原子序数为1,T为H元素;X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同,则核外电子排布为1s22s22p2,故X为C元素;R元素原子3p能级上有1个电子,外围电子排布为3s23p1,故R为Al元素;Z的基态原子价电子排布为ns2npn+2,结合原子序数可知,Z处于第二周期,即n=2,则Z为O元素;Y的原子序数介于碳元素、氧元素之间,则Y为N元素;Q的原子序数大于氧元素小于Al元素,在该元素所在周期中,Q的基态原子的第一电离能最小,故Q处于第三周期,为Na元素;W的一种核素的质量数为65,中子数为36,质子数为65-36=29,故W为Cu元素,
(1)同一周期自左而右电负性递增,同主族自上而下电负性减弱,故电负性:N>C>Na,
故答案为:N>C>Na;
(2)C与N原子结合形成的C3N4晶体,C原子大于N原子,所以C-C的键长比C-N键的键长长,所以C3N4晶体硬度比金刚石大,故答案为:高;
(3)Cu原子核外电子数为29,基态原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu2+的核外电子排布式为:[Ar]3d9;A、O2中氧元素的化合价是0价,HO2中氧元素的化合价是-0.5价,化合价降低作氧化剂,故A正确;?
B、HO2为超氧酸,应具有酸性,可与碱反应,故HO2在碱中不能稳定存在,故B正确;
C、还原产物是HO2,故C错误;
D、1molCu参加反应生成+1价铜离子,有1mol电子发生转移,故D正确,
根据以上分析可知,不正确的为C,
故答案为:[Ar]3d9;C;
(4)X、Y、Z分别为C、N、O与氢元素可以构成A、B、C、D等多种粒子,其中A、B、C均为10电子微粒,D为18电子微粒,A为5原子核的+1价阳离子,铵根离子,正四面体结构,中心原子sp3,则A+的中心原子杂化方式为sp3,B为4原子核的+1价阳离子即H3O+,则B+电子式为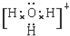 ,C为4个原子核构成的分子,则C为NH3,C分子中中心原子N形成3对σ键和1对孤对电子,所以杂化类型为sp3,与C互为等电子体的分子是
,C为4个原子核构成的分子,则C为NH3,C分子中中心原子N形成3对σ键和1对孤对电子,所以杂化类型为sp3,与C互为等电子体的分子是 ,D分子中两元素的原子个数之比为1:1即H2O2,则D为极性分子;某双原子单质分子E也为18电子微粒,所以E是氟气,与水反应的方程式为:2F2+2H2O=4HF+O2
,D分子中两元素的原子个数之比为1:1即H2O2,则D为极性分子;某双原子单质分子E也为18电子微粒,所以E是氟气,与水反应的方程式为:2F2+2H2O=4HF+O2
,故答案为:sp3;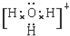 ;
; ;极性;2F2+2H2O=4HF+O2;
;极性;2F2+2H2O=4HF+O2;
(5)已知25℃、101kPa条件下:
①4R(s)+3Z2(g)=2R2Z3(s)△H=-2834.9kJ/mol
②4R(s)+2Z3(g)=2R2Z3(s)△H=-3119.1kJ/mol
根据盖斯定律,则①-②得3Z2(g)=2Z3(g)△H=+284.2kJ/mol
故16g Z2(g)完全转化为Z3(g)的△H=+284.2kJ/mol×$\frac{16g}{3mol×32g/mol}$=+47.4 kJ/mol,
故答案为:+47.4 kJ/mol.
点评 本题考查结构性质位置关系、核外电子排布规律、电负性、晶体类型与化学键、反应热计算等,题目较为综合,难度中等,注意对基础知识的全面掌握,注意(5)中利用盖斯定律计算反应热.

| A. | 硫酸亚铁加过氧化氢溶液离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O | |
| B. | 碘水中通入足量的SO2离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 在碳酸氢钠溶液中:K+、Al3+、SO42-、Cl-可大量共存 | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变反应物浓度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变反应的限度 | |
| D. | 催化剂不能控制化学反应的限度 |
| A. | Y与X、Z、W分别能形成两种化合物 | |
| B. | Z与W形成的Z2W型化合物在水溶液中Z+离子与W2-离子个数比为2:1 | |
| C. | Y、Z、W不可能形成水溶液呈碱性的化合物 | |
| D. | 化合物X Y2、X YW、X W2随着共价键的键长逐渐增大,熔沸点逐渐降低 |
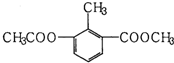
| A. | 一个分子中含有12个H原子 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 苯环上的一氯代物有2种 | |
| D. | 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol |
| A. | 乙烯与溴化氢制溴乙烷与苯与溴反应制溴苯 | |
| B. | 蛋白质水解生成氨基酸与淀粉发酵生成酒精 | |
| C. | 乙醇脱水制乙烯与乙醇、乙酸脱水制乙酸乙酯 | |
| D. | 甲烷和氯气制一氯甲烷与苯和硝酸反应制硝基苯 |




 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系:
 或
或 .
. .
.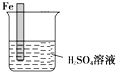 生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.
生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.