题目内容
13.垃圾分类有利于资源回收利用.下列垃圾归类不合理的是| A | B | C | D | |
| 垃圾分类 | 废易拉罐 | 不可再生废纸 | 废电池 | 废塑料瓶 |
 可回收物 |  可燃垃圾 |  有害垃圾 |  其它垃圾 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.废易拉罐主要材料为铝质,铝可回收;
B.废纸含有大量纤维,可以燃烧;
C.废电池中含有重金属等有害物质;
D.废塑料瓶主要由聚乙烯或聚丙烯制造而成,可回收利用.
解答 解:A.废易拉罐主要材料为铝质,属于可回收利用的材料,属于可回收物,故A正确;
B.废纸含有大量纤维,可以燃烧,所以属于可燃垃圾,故B正确;
C.废电池中含有重金属等有害物质,所以属于有害垃圾,故C正确;
D.废塑料瓶主要由聚乙烯或聚丙烯制造而成,也可回收利用,所以属于可回收物,故D错误.
故选D.
点评 本题考查化学试剂的分类,难度不大,可回收垃圾主要包括废纸、塑料、玻璃、金属和布料五大类,通过综合处理回收利用,可以减少污染,节省资源.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
3.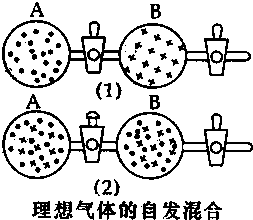 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )| A. | 此过程是从混乱程度小的向混乱程度大变化过程,即熵增大的过程 | |
| B. | 此过程为自发过程,而且没有热量的吸收或放出 | |
| C. | 此过程从有序到无序,混乱度增大 | |
| D. | 此过程是自发可逆的 |
4.萜类物质中有许都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式):
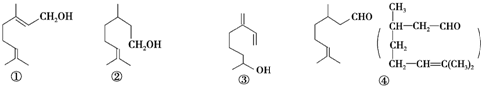
关于上述四种香料,下列说法正确的是( )

关于上述四种香料,下列说法正确的是( )
| A. | ②和③均属于烯烃类 | B. | ①和③互为同分异构体 | ||
| C. | ④是②的氧化产物 | D. | ③和④均能发生消去、酯化反应 |
1.人类为了维持生命和健康,需要摄取多种食物.
(1)下列食物中富含糖类的是A(填序号).

(2)运动饮料中常含有钠、钾、钙等元素,饮用这种饮料能为人体提供水和无机盐填(营养素名称).
(3)当人体内缺少钙时,可能患有的疾病是AC(填序号).
A.骨质疏松 B.夜盲症 C.佝偻病 D.坏血病
(4)X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见下表.
①X属于化合物(填“单质”或“化合物”).
②该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
(1)下列食物中富含糖类的是A(填序号).

(2)运动饮料中常含有钠、钾、钙等元素,饮用这种饮料能为人体提供水和无机盐填(营养素名称).
(3)当人体内缺少钙时,可能患有的疾病是AC(填序号).
A.骨质疏松 B.夜盲症 C.佝偻病 D.坏血病
(4)X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见下表.
| 物质 | 甲 | 乙 | 丙 |  |
| 微观示意图 |  |  | 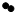 |
②该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
8.下列化学用语表达正确的是( )
| A. | 环已烷的结构简式  | B. | C2H4的球棍模型 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式 |
18.在下列几种物质中跟HCl溶液和NaOH溶液都能发生反应的是( )
①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥A12O3.
①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥A12O3.
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有①②③⑤⑥ | D. | 全部都可以 |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
2.已知维生素A的结构简式如图,关于它的说法正确的是( )
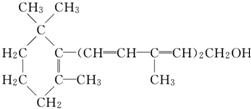

| A. | 维生素A是一种醇 | |
| B. | 维生素A的一个分子中含有三个碳碳双键 | |
| C. | 维生素A的一个分子中有33个氢原子 | |
| D. | 维生素A不能使溴的CCl4溶液褪色 |
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(1)X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为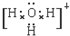 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是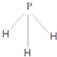 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
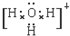 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.