题目内容
8.化合物A结构简式为 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系:
完成下列填空:
(1)关于上述各步转化,下列说法正确的是ab(选填序号).
a.以上转化未涉及加成反应
b.D比C的相对分子质量小18
c.A、B、C、D中都含有-COOH
d.A跟C发生酯化反应,产物分子式为C18H18O4Cl
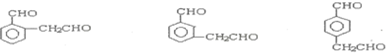
(2)A可能的结构简式有:
 或
或 .
.(3)D的分子式为C9H8O2,可能的结构有3种.
(4)若D中除苯环外,还有一个六元环,写出A→B的化学方程式:
 .
.
分析 A的结构简式是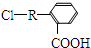 ,D的式量为148,分子组成符合CaHbO2,$\frac{148-32}{12}$=9…8,则D为C9H8O2,由转化,A碱性水解得B,B酸化得C,C脱去一分子水得D,D的分子为C9H8O2,分子中有9个碳原子,所以A为
,D的式量为148,分子组成符合CaHbO2,$\frac{148-32}{12}$=9…8,则D为C9H8O2,由转化,A碱性水解得B,B酸化得C,C脱去一分子水得D,D的分子为C9H8O2,分子中有9个碳原子,所以A为 或
或 ,B为
,B为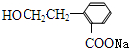 或
或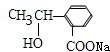 ,
,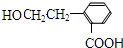 C为
C为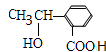 ,据此答题.
,据此答题.
解答 解:A的结构简式是 ,D的式量为148,分子组成符合CaHbO2,$\frac{148-32}{12}$=9…8,则D为C9H8O2,由转化,A碱性水解得B,B酸化得C,C脱去一分子水得D,D的分子为C9H8O2,分子中有9个碳原子,所以A为
,D的式量为148,分子组成符合CaHbO2,$\frac{148-32}{12}$=9…8,则D为C9H8O2,由转化,A碱性水解得B,B酸化得C,C脱去一分子水得D,D的分子为C9H8O2,分子中有9个碳原子,所以A为 或
或 ,B为
,B为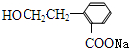 或
或 ,C为
,C为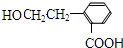 或
或 ,
,
(1)a.转化中涉及取代反应、中和反应、氧化反应、消去反应,以上各步没有涉及加成反应,故a正确;
b.E与C相差1个O原子和2个H原子,则E比C的相对分子质量小18,故b正确
c.由上述分析可知,A、C、D中都含有-COOH,而B中不含有,故c错误;
d.A与C发生酯化反应后,还生成水,则得到的有机物分子式可能是C18H17O4Cl,故d错误;
故答案为:ab;
(2)根据上面的分析可知,A可能的结构简式有: 或
或 ,
,
故答案为: 或
或 ;
;
(3)根据上面的分析可知,D的分子式为 C9H8O2,因为C为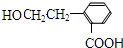 或
或 ,C可以是中羟基与羧基脱去一分子水得环酯,有2种结构,也可以是羟基与邻位碳上的氢原子脱水得碳碳双键,所以D的结构可能有3种,
,C可以是中羟基与羧基脱去一分子水得环酯,有2种结构,也可以是羟基与邻位碳上的氢原子脱水得碳碳双键,所以D的结构可能有3种,
故答案为:C9H8O2;3;
(4)若D中除苯环外,还有一个六元环,则D为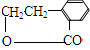 ,可以反推得A为
,可以反推得A为 ,所以A→B的化学方程式为
,所以A→B的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意转化中有机物的碳链骨架不变及官能团的变化来推断各物质,明确常见有机物的性质即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在下列几种物质中跟HCl溶液和NaOH溶液都能发生反应的是( )
①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥A12O3.
①NaHCO3、②Al(OH)3、③(NH4)2CO3、④SiO2、⑤金属铝、⑥A12O3.
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有①②③⑤⑥ | D. | 全部都可以 |
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:2Fe(OH)3-6e-+10OH-═2FeO42-+8H2O | |
| C. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| D. | 放电时正极附近溶液的碱性增强 |
16.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
| A. | NH3、HD、C3H8 | B. | PCl3、CO2、H2SO4 | C. | SO2、BN、P2O5 | D. | CCl4、Na2S、H2O2 |
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(1)X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为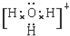 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是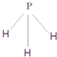 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
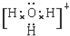 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
13.下列各组物质中发生铝热反应的是( )
| A. | 铝粉和Fe2O3粉末 | B. | 木炭粉和CuO粉末 | C. | 铝粉和MgO粉末 | D. | 铝粉和稀盐酸 |
20.下列含有共价键的离子化合物的是( )
| A. | Na2O | B. | CaCl2 | C. | NH4Cl | D. | H2O2 |
 (包括顺反异构)
(包括顺反异构)
 .
.