题目内容
14.下列关于离子反应的说法中正确的是( )| A. | 硫酸亚铁加过氧化氢溶液离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O | |
| B. | 碘水中通入足量的SO2离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 在碳酸氢钠溶液中:K+、Al3+、SO42-、Cl-可大量共存 | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.二氧化硫被碘单质氧化成硫酸;
C.碳酸氢钠与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
D.使紫色石蕊试液呈红色的溶液中存在大量氢离子,碳酸根离子与氢离子反应.
解答 解:A.硫酸亚铁加过氧化氢溶液,亚铁离子被氧化成铁离子,正确的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故A错误;
B.碘水中通入足量的SO2,二者发生氧化还原反应,反应的方程式为:I2+SO2+2H2O═2I-+SO42-+4H+,故B正确;
C.碳酸氢钠与Al3+发生双水解反应,在溶液中不能大量共存,故C错误;
D.使紫色石蕊试液呈红色的溶液为酸性溶液,CO32-与酸性溶液反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子方程式、离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则、离子共存的条件,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
4.萜类物质中有许都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式):

关于上述四种香料,下列说法正确的是( )

关于上述四种香料,下列说法正确的是( )
| A. | ②和③均属于烯烃类 | B. | ①和③互为同分异构体 | ||
| C. | ④是②的氧化产物 | D. | ③和④均能发生消去、酯化反应 |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
2.已知维生素A的结构简式如图,关于它的说法正确的是( )
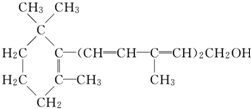

| A. | 维生素A是一种醇 | |
| B. | 维生素A的一个分子中含有三个碳碳双键 | |
| C. | 维生素A的一个分子中有33个氢原子 | |
| D. | 维生素A不能使溴的CCl4溶液褪色 |
9.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式: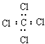 | D. | 3,3,4-三甲基已烷的分子式C9H20 |
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:2Fe(OH)3-6e-+10OH-═2FeO42-+8H2O | |
| C. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| D. | 放电时正极附近溶液的碱性增强 |
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(1)X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为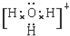 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
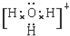 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
6.化学与社会、环境、生活等密切相关.下列有关说法中错误的是( )
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
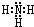 .
.