题目内容
15.下列反应类型相同的是( )| A. | 乙烯与溴化氢制溴乙烷与苯与溴反应制溴苯 | |
| B. | 蛋白质水解生成氨基酸与淀粉发酵生成酒精 | |
| C. | 乙醇脱水制乙烯与乙醇、乙酸脱水制乙酸乙酯 | |
| D. | 甲烷和氯气制一氯甲烷与苯和硝酸反应制硝基苯 |
分析 A、乙烯与溴化氢制溴乙烷为加成反应,苯与溴反应制溴苯为取代反应;
B、蛋白质水解生成氨基酸为水解反应;淀粉发酵生成酒精不是水解反应;
C、乙醇制取乙烯为消去反应,乙酸制取乙酸乙酯为取代反应;
D、甲烷与氯气发生取代反应,苯与不\浓硝酸反应生成硝基苯为取代反应,据此解答即可.
解答 解:A、乙烯与HBr反应制取溴乙烷为加成反应,苯与溴反应制取溴苯为取代反应,两者不同,故A错误;
B、蛋白质水解为水解反应淀粉变为酒精不是水解反应,故两者不同,故B错误;
C、乙醇脱水为消去反应,乙酸与乙醇发生酯化反应生成乙酸乙酯,也为取代反应.两者不同,故C错误;
D、甲烷与氯气反应生成一氯甲烷为取代反应,苯在浓硫酸作用下与浓硝酸反应生成硝基苯为取代反应,两者类型相同,故D正确,故选D.
点评 本题考查有机物的结构与性质,侧重有机反应类型的考查,熟悉烯烃、烷烃的性质及常见有机反应类型即可解答,题目难度不大.

练习册系列答案
相关题目
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(1)X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为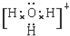 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
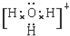 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
6.化学与社会、环境、生活等密切相关.下列有关说法中错误的是( )
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
3.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2KMnO4+5H2C2O4+3H2SO4═2MnSO4+10CO2↑+K2SO4+8H2O用一定量的混合溶液(其中KMnO4为4.0mL 0.2mol•L-1、H2C2O4为2.0mL 0.5mol•L-1)来探究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| B. | 0.1mol.L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| C. | 强酸性溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1mol.L-1NaAlO2溶液:NH4+、Na+、OH-、CO32- |
4.下列有机物属于脂肪烃的是( )
| A. | 新戊烷 | B. | 氯乙烷 | C. | 硬脂酸 | D. | 甲苯 |
5.某化学反应中,生成物D的物质的量浓度在5s时为1.0mol/L,在10s时为1.5mol/L,则在这段时间内D的平均反应速率为( )
| A. | 0.15 mol/(L•s) | B. | 0.2 mol/(L•s) | C. | 0.1 mol/(L•s) | D. | 0.05mol/(L.s) |
 乙酸是白醋中的主要成分.
乙酸是白醋中的主要成分.