题目内容
12.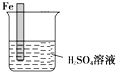 生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.
生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.(1)在图中画出完整的装置图,标出另一电极材料和电子流向.
(2)铁电极是该原电池的正极,发生还原反应,电极反应式为2H++2e-=H2↑,溶液中的SO42-向负极移动.
(3)该反应是放热反应,则生成物的总能量<反应物的总能量(填“>”或“<”).
分析 利用原电池装置对金属Fe进行防护,Fe应为原电池的正极,氢离子在Fe表面发生还原反应生成氢气,比Fe活泼的金属作负极,溶液中的阴离子移向负极,反应物能量高于生成物时,反应放热,据此分析.
解答 解:(1)利用原电池装置对金属Fe进行防护,Fe应为原电池的正极,比Fe活泼的金属作负极,如图: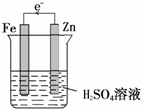 ,
,
故答案为: ;
;
(2)Fe为原电池的正极,氢离子在Fe表面发生还原反应生成氢气,溶液中的阴离子移向负极,故答案为:正;还原;2H++2e-=H2↑;负;
(3)反应物能量高于生成物时,反应放热,故答案为:<.
点评 本题考查了金属的电化学防护、原电池原理、焓变与反应物生成物能量的关系,知识较基础,题目难度不大.

练习册系列答案
相关题目
2.已知维生素A的结构简式如图,关于它的说法正确的是( )
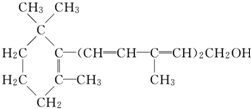

| A. | 维生素A是一种醇 | |
| B. | 维生素A的一个分子中含有三个碳碳双键 | |
| C. | 维生素A的一个分子中有33个氢原子 | |
| D. | 维生素A不能使溴的CCl4溶液褪色 |
3.T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
(1)X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为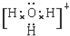 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是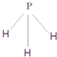 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要高(填“高”、“低”).
(3)W2+的核外电子排布式为[Ar]3d9.元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是C
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1molW参加反应有1mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子.其中A、B、C均为10电子微粒,D为18电子微粒.A为5原子核的+1价阳离子,则A+的中心原子杂化方式为sp3.B为4原子核的+1价阳离子,则B+电子式为
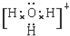 .C为4个原子核构成的分子,则与C互为等电子体的分子可以是
.C为4个原子核构成的分子,则与C互为等电子体的分子可以是 (写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.
(写结构式).D分子中两元素的原子个数之比为1:1,则D为极性(填“极性”或“非极性”)分子.某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为2F2+2H2O=4HF+O2.(5)已知25℃、101kPa条件下:
4R(s)+3Z2(g)═2R2Z3(s)△H=-2835.9kJ/mol
4R(s)+2Z3(g)═2R2Z3(s)△H=-3119.1kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=+47.4 kJ/mol.
20.下列含有共价键的离子化合物的是( )
| A. | Na2O | B. | CaCl2 | C. | NH4Cl | D. | H2O2 |
7.已知aXm+、bYn-、cZm-(m>n)三中离子具有相同的电子层结构,下列关系正确的是( )
| A. | 原子序数:a>b>c | B. | 离子半径:Yn->Zm- | ||
| C. | a-b=m-n | D. | 原子核外最外层电子数:X>Y>Z |
6.化学与社会、环境、生活等密切相关.下列有关说法中错误的是( )
| A. | 液氨可用作制冷剂 | |
| B. | 硅酸钠用于制备硅胶和木材防火剂的原料 | |
| C. | 用热的纯碱溶液洗涤油污 | |
| D. | 明矾可用于自来水的杀菌消毒 |
3.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2KMnO4+5H2C2O4+3H2SO4═2MnSO4+10CO2↑+K2SO4+8H2O用一定量的混合溶液(其中KMnO4为4.0mL 0.2mol•L-1、H2C2O4为2.0mL 0.5mol•L-1)来探究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
4.下列有机物属于脂肪烃的是( )
| A. | 新戊烷 | B. | 氯乙烷 | C. | 硬脂酸 | D. | 甲苯 |
 (包括顺反异构)
(包括顺反异构)
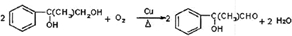
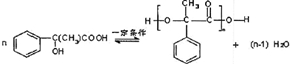
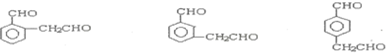 .
.