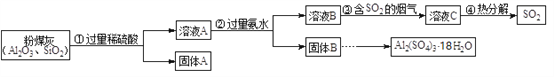
��Ŀ����
����Ŀ��������ˮ��ijЩ��ҵ��ˮ�еĺ��������ᆳת�����ջ��������ε���ʽ����ˮ�壬�������ŷŻ����ˮ�帻Ӫ���������������Fe��ȥ��ˮ���е������Σ�NO3-���ѳ�Ϊ�������о����ȵ�֮һ��Fe��ԭˮ����NO3-�ķ�Ӧԭ������ͼ��ʾ��
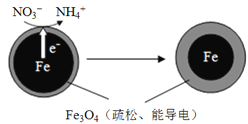
��1������˵������ˮ����Ⱦ��Σ������______������ĸ����
a���Ӿ�ˮ��Դ��ȱ b��Σ�����彡��
��2��NO3-�е�Ԫ�صĻ��ϼ�Ϊ______��
��3��Fe�ڷ�Ӧ�����з�������______��ѡ����������������ԭ������Ӧ��
��4������������Ͷ��ijˮ�������У���һ��ʱ������Һ������Ũ�ȵ��й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | H+ | NO3 | NH4+ | Fe2+ |
Ũ��/��mol��L1�� | 5.0��102 | 5.0��102 | 6.4��101 | y | 2.4��101 |
����y ��______��
���𰸡� a b +5 ���� 6.0��102
����������1��a��ˮ����Ⱦ��Ӿ�ˮ��Դ��ȱ��a��ȷ��b��ˮ����ȾΣ�����彡����b��ȷ����ѡab����2�����ݻ��ϼ۴�����Ϊ0��֪NO3���е�Ԫ�صĻ��ϼ�Ϊ+��3��2��1����+5����3��Fe�ǻ��õĽ������ڷ�Ӧ������ʧȥ��������������������Ӧ����4��������������Ũ�ȸ�����Һ�е���غ��֪c(Na+)+c(H+)+c(NH4+)+2c(Fe2+)=c(NO3)������y����0.64��0.05��0.05��0.24��2��mol/L��0.06mol/L��