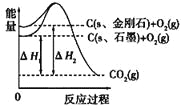
题目内容
【题目】五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:A原子核外电子总数是内层电子数的三倍,A、E同主族;B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H;C的焰色应呈黄色;D在同周期中形成的简单离子,其离子半径最小;
回答下列问题:
(1)写出D在元素周期表中的位置:______________。
(2)化合物H的水溶液pH_______7(填“大于”、“等于”“小于”),其原因是______________用离子方程式表示。
(3)上述元素的最高价氧化物对应水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式:_______。
(4)请设计实验证明A、B、E的非金属性强弱关系:________。
【答案】 第三周期、 第IIIA族 小于 NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+ ![]() 将过量的稀硝酸加入到碳酸钠溶液中,观察到气泡,再将生成的二氧化碳除去挥发出的HNO3通入到硅酸钠溶液,观察到有白色沉淀生成,证明非金属性N>C>Si
将过量的稀硝酸加入到碳酸钠溶液中,观察到气泡,再将生成的二氧化碳除去挥发出的HNO3通入到硅酸钠溶液,观察到有白色沉淀生成,证明非金属性N>C>Si
【解析】由已知A、B、C、D、E为原子序数依次增大的短周期元素,A原子核外电子总数是内层电子数的三倍,则A为碳元素;A、E同主族,则E为硅元素;B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H,则B为氮元素、F为硝酸、G为氨气、H为硝酸铵;C的焰色应呈黄色,则C为钠元素;D在同周期中形成的简单离子,离子半径最小,且原子序数大于钠,则D为铝元素。
(1)D为铝元素,在元素周期表中处于第三周期第ⅢA族。
(2)化合物H为硝酸铵,属于强酸弱碱盐,由于铵根离子水解,使其水溶液呈酸性,所以pH<7,用离子方程式表示为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)A、B、C、D、E的最高价氧化物对应水化物分别为:碳酸、硝酸、氢氧化钠、氢氧化铝、硅酸,其中氢氧化钠在一定条件下均能与其他四种物质发生化学反应,其的电子式为:![]() 。
。
(4)元素的非金属性越强,对应的最高价含氧酸的酸性越强,根据强酸制弱酸原理设计实验,将过量的稀硝酸加入到碳酸钠溶液中,观察到气泡,再将生成的二氧化碳除去挥发出的HNO3然后通入到硅酸钠溶液中,观察到有白色沉淀生成,则证明非金属性N>C>Si。

【题目】生活污水和某些工业废水中的含氮化合物经转化最终会以硝酸盐的形式进入水体,若大量排放会造成水体富营养化。用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如右图所示。
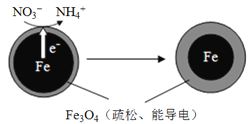
(1)下列说法属于水体污染的危害的有______(填字母)。
a.加剧水资源短缺 b.危害人体健康
(2)NO3-中氮元素的化合价为______。
(3)Fe在反应过程中发生的是______(选填“氧化”或“还原”)反应。
(4)将足量铁粉投入某水体样本中,经一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计)。
离子 | Na+ | H+ | NO3 | NH4+ | Fe2+ |
浓度/(mol·L1) | 5.0×102 | 5.0×102 | 6.4×101 | y | 2.4×101 |
表中y =______。