题目内容
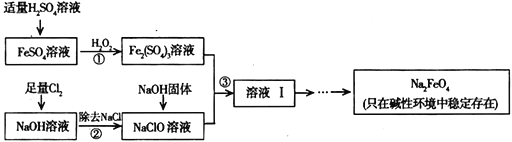
【题目】大量燃煤产生烟气会造成空气中二氧化硫含量增多,某研究小组利用燃煤电厂的固体废弃物粉煤灰(主要含Al2O3、SiO2等)进行烟气脱硫研究,并制备Al2(SO4)3·18H2O。
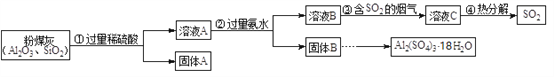
(1)上述①②③④步实验操作中,需要过滤的是______。
(2)第②步不能用氢氧化钠溶液的原因是______(用化学方程式表示)。
(3)下列关于步骤③、④的说法正确的是______。
a.溶液C可用于制备氮肥
b.溶液B中的硫酸铵将烟气中的SO2除去
c.热分解获得的SO2可以回收再利用
(4)从固体B制备Al2(SO4)3·18H2O的实验操作是:加入稀硫酸、加热浓缩、______、过滤。
【答案】 ①② Al(OH)3 + NaOH=NaAlO2 + 2H2O或 Al2(SO4)3 + 8NaOH=2NaAlO2 + 2Na2SO4 + 4H2O a、c 冷却结晶
【解析】二氧化硅与稀硫酸不反应,过滤得到的固体A是二氧化硅;溶液A中含有硫酸铝及过量的稀硫酸,加入过量的氨水生成氢氧化铝沉淀,过滤得到固体B是氢氧化铝,溶液B中含有过量的氨水,与足量的二氧化硫反应生成亚硫酸氢铵,亚硫酸氢铵分解又得到二氧化硫。
(1)根据以上分析可知上述①②③④步实验操作中,需要过滤的是①②。(2)生成的氢氧化铝能与过量的氢氧化钠反应生成偏铝酸钠,所以第②步不能用氢氧化钠溶液,反应的化学方程式为Al(OH)3 +NaOH=NaAlO2+2H2O或Al2(SO4)3+8NaOH=2NaAlO2+2Na2SO4+4H2O。(3)a.溶液C中含有硫酸铵、亚硫酸氢铵,可用于制备氮肥,a正确;b.溶液B中的氨水将烟气中的SO2除去,b错误;c.热分解获得的SO2可以回收再利用,c正确;答案选ac;(4)从固体B制备Al2(SO4)3·18H2O的实验操作是:加入稀硫酸、加热浓缩、冷却结晶、过滤。

 名校课堂系列答案
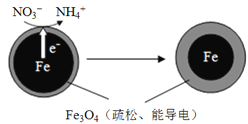
名校课堂系列答案【题目】生活污水和某些工业废水中的含氮化合物经转化最终会以硝酸盐的形式进入水体,若大量排放会造成水体富营养化。用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如右图所示。
(1)下列说法属于水体污染的危害的有______(填字母)。
a.加剧水资源短缺 b.危害人体健康
(2)NO3-中氮元素的化合价为______。
(3)Fe在反应过程中发生的是______(选填“氧化”或“还原”)反应。
(4)将足量铁粉投入某水体样本中,经一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计)。
离子 | Na+ | H+ | NO3 | NH4+ | Fe2+ |
浓度/(mol·L1) | 5.0×102 | 5.0×102 | 6.4×101 | y | 2.4×101 |
表中y =______。