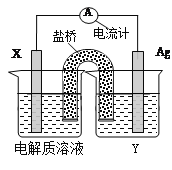
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩAΓΔBΓΔCΓΔDΕΦ «ΕΧ÷ήΤΎ‘ΣΥΊΘ§‘≠Ή”ΑκΨΕΘΚDΘΨCΘΨAΘΨBΓΘ“―÷ΣΘΚAΓΔBΆ§÷ήΤΎΘ§AΓΔC¥Π”ΎΆ§“Μ÷ςΉεΘΜC‘≠Ή”ΚΥΡΎΒΡ÷ Ή” ΐΒ»”ΎAΓΔB‘≠Ή”ΚΥΡΎΒΡ÷ Ή” ΐ÷°ΚΆΘΜC‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐ « D‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐΒΡ3±ΕΓΘ ‘ΜΊ¥πΘΚ
Θ®1Θ©–¥≥ω‘ΣΥΊΒΡΟϊ≥ΤΘΚA________ΓΔC________ΓΘ
Θ®2Θ©–¥≥ω”…BΓΔDΉι≥…ΒΡΝΫ÷÷Μ·ΚœΈοΒΡΒγΉ” ΫΖ÷±πΈΣΘΚ_______ΓΔ_______ΓΘ
Θ®3Θ©CΒΡΙΧΧ§―θΜ·Έο τ”Ύ_______ΨßΧεΘ§–¥≥ω±μ ΨCΒΡ―θΜ·ΈοΒΡ“Μ÷÷÷Ί“ΣΒΡΙ˓”ϢΨ_______ΓΘ
Θ®4Θ©AΓΔCΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·Έο÷–Υα–‘Ϋœ«ΩΒΡ «_______ Θ®–¥Υ°Μ·ΈοΒΡΖ÷Ή” ΫΘ©ΓΘ
Θ®5Θ©–¥≥ωCΒΡ―θΜ·Έο”κDΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ___________ΓΘ
ΓΨ¥πΑΗΓΩ ≈π ¬Ν ![]()
![]() άκΉ” ΉςΡΆΜπ≤ΡΝœΜρΒγΫβ“±¬Ν H3BO3 Al2O3+2OHΓΣ+3H2O®T2[Al(OH)4]ΓΣΜρAl2O3+2OHΓΣ®T2AlO2-+H2O
άκΉ” ΉςΡΆΜπ≤ΡΝœΜρΒγΫβ“±¬Ν H3BO3 Al2O3+2OHΓΣ+3H2O®T2[Al(OH)4]ΓΣΜρAl2O3+2OHΓΣ®T2AlO2-+H2O
ΓΨΫβΈωΓΩ
AΓΔBΓΔCΓΔDΕΦ «ΕΧ÷ήΤΎ‘ΣΥΊΘ§‘≠Ή”ΑκΨΕΘΚDΘΨCΘΨAΘΨBΓΘ“―÷ΣΘΚAΓΔBΆ§÷ήΤΎΘ§AΓΔC¥Π”ΎΆ§“Μ÷ςΉεΘ§‘ρAΓΔBΈΣΒΎΕΰ÷ήΤΎ‘ΣΥΊΘ§CΈΣΒΎ»ΐ÷ήΤΎ‘ΣΥΊΘ§“ρ¥ΥAΓΔC‘≠Ή”–ρ ΐœύ≤ν8Θ§C‘≠Ή”ΚΥΡΎΒΡ÷ Ή” ΐΒ»”Ύ AΓΔB‘≠Ή”ΚΥΡΎΒΡ÷ Ή” ΐ÷°ΚΆΘ§‘ρB ‘≠Ή”ΒΡ÷ Ή” ΐΈΣ 8Θ§Φ¥BΈΣO‘ΣΥΊΘΜ”… C‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐ «D‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐΒΡ 3±ΕΘ§»τDΉνΆβ≤ψΈΣ1ΒγΉ”Θ§‘ρ CΉνΆβ≤ψΈΣ3ΗωΒγΉ”Θ§»τDΉνΆβ≤ψ « 2ΗωΒγΉ”Θ§‘ρ CΉνΆβ≤ψ « 6ΗωΒγΉ”Θ§‘ρ C”κB «Ά§÷ςΉε‘ΣΥΊΝΥΘ§≤ΜΖϊΚœΧβ“βΘ§Ι CΈΣAl‘ΣΥΊΘ§‘≠Ή”ΑκΨΕΘΚDΘΨCΘ§‘ρDΈΣ Na‘ΣΥΊΘ§AΈΣ B‘ΣΥΊΓΘ
(1)AΈΣ B‘ΣΥΊΘ§CΈΣ Al‘ΣΥΊΘ§Ι ¥πΑΗΈΣΘΚ≈πΘΜ¬ΝΘΜ
(2)”… BΓΔD Ήι≥…ΒΡΝΫ÷÷Μ·ΚœΈοΖ÷±πΈΣ Na2OΓΔNa2O2Θ§ΕΦ τ”ΎάκΉ”Μ·ΚœΈοΘ§ΒγΉ” ΫΖ÷±πΈΣ![]() ΓΔ
ΓΔ![]() Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ![]() ΓΔ
ΓΔ![]() ΘΜ
ΘΜ
(3)CΈΣAl‘ΣΥΊΘ§Ε‘”ΠΒΡ―θΜ·ΈοΈΣ Al2O3Θ§ΈΣάκΉ”Μ·ΚœΈοΘ§ΙΧΧεΈΣάκΉ”ΨßΧεΘΜ»έΒψΗΏΓΔ”≤Ε»¥σΘ§≥Θ”ΟΉςΡΆΜπ≤ΡΝœΘ§“≤≥Θ”Ο”ΎΒγΫβ“±ΝΕ¬ΝΒΡ‘≠ΝœΘ§Ι ¥πΑΗΈΣΘΚάκΉ”ΘΜΉςΡΆΜπ≤ΡΝœΜρΒγΫβ“±¬ΝΘΜ
(4)AΓΔCΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΖ÷±πΈΣH3BO3ΓΔAl(OH)3Θ§Τδ÷–H3BO3ΈΣ“Μ‘ΣΥαΘ§Al(OH)3ΈΣΝΫ–‘«β―θΜ·ΈοΘ§Υα–‘«ΩΒΡ « H3BO3Θ§Ι ¥πΑΗΈΣΘΚH3BO3ΘΜ
(5)Al2O3ΈΣΝΫ–‘―θΜ·ΈοΘ§Ρή”κNaOH»ή“ΚΖ¥”ΠΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚAl2O3+2OHΓΣ+3H2O®T2[Al(OH)4]ΓΣΜρAl2O3+2OHΓΣ®T2AlO2-+H2OΘ§Ι ¥πΑΗΈΣΘΚAl2O3+2OHΓΣ+3H2O®T2[Al(OH)4]ΓΣΜρAl2O3+2OHΓΣ®T2AlO2-+H2OΓΘ

 Κ°ΦΌ¥¥–¬–ΆΉ‘÷ς―ßœΑΒΎ»ΐ―ßΤΎΚ°ΦΌœΈΫ”œΒΝ–¥πΑΗ
Κ°ΦΌ¥¥–¬–ΆΉ‘÷ς―ßœΑΒΎ»ΐ―ßΤΎΚ°ΦΌœΈΫ”œΒΝ–¥πΑΗΓΨΧβΡΩΓΩœ¬±μΈο÷ Α¥ΦνΓΔΥαΓΔ―ΈΓΔΦν–‘―θΜ·ΈοΓΔΥα–‘―θΜ·ΈοΒΡΥ≥–ρΖ÷άύ’ΐ»ΖΒΡ «Θ® Θ©
Φν | Υα | ―Έ | Φν–‘―θΜ·Έο | Υα–‘―θΜ·Έο | |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | KOH | HCl | NaCl | CaO | CO |
C | NaOH | H2CO3 | CaCl2 | CuO | SO2 |
D | NaOH | HNO3 | BaCO3 | NO | SO3 |
A.AB.BC.CD.D
ΓΨΧβΡΩΓΩ…ζΜνΈέΥ°ΚΆΡ≥–©ΙΛ“ΒΖœΥ°÷–ΒΡΚ§ΒΣΜ·ΚœΈοΨ≠ΉΣΜ·Ήν÷’Μα“‘œθΥα―ΈΒΡ–Έ ΫΫχ»κΥ°ΧεΘ§»τ¥σΝΩ≈≈Ζ≈Μα‘λ≥…Υ°ΧεΗΜ”Σ―χΜ·ΓΘ”ΟΝψΦέΧζΘ®FeΘ©»Ξ≥ΐΥ°Χε÷–ΒΡœθΥα―ΈΘ®NO3-Θ©“―≥…ΈΣΜΖΨ≥–όΗ¥―–ΨΩΒΡ»»Βψ÷°“ΜΓΘFeΜΙ‘≠Υ°Χε÷–NO3-ΒΡΖ¥”Π‘≠άμ»γ”“ΆΦΥυ ΨΓΘ
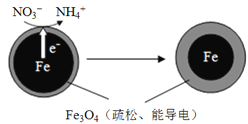
Θ®1Θ©œ¬Ν–ΥΒΖ® τ”ΎΥ°ΧεΈέ»ΨΒΡΈΘΚΠΒΡ”–______Θ®ΧνΉ÷ΡΗΘ©ΓΘ
aΘ°Φ”ΨγΥ°Ή ‘¥ΕΧ»± bΘ°ΈΘΚΠ»ΥΧεΫΓΩΒ
Θ®2Θ©NO3-÷–ΒΣ‘ΣΥΊΒΡΜ·ΚœΦέΈΣ______ΓΘ
Θ®3Θ©Fe‘ΎΖ¥”ΠΙΐ≥Χ÷–ΖΔ…ζΒΡ «______Θ®―ΓΧνΓΑ―θΜ·Γ±ΜρΓΑΜΙ‘≠Γ±Θ©Ζ¥”ΠΓΘ
Θ®4Θ©ΫΪΉψΝΩΧζΖέΆΕ»κΡ≥Υ°Χε―υ±Ψ÷–Θ§Ψ≠“ΜΕΈ ±ΦδΚσΘ§≤βΒΟ»ή“Κ÷–άκΉ”≈®Ε»ΒΡ”–ΙΊ ΐΨί»γœ¬Θ®ΤδΥϊάκΉ”Κω¬‘≤ΜΦΤΘ©ΓΘ
άκΉ” | Na+ | H+ | NO3 | NH4+ | Fe2+ |
≈®Ε»/Θ®molΓΛL1Θ© | 5.0ΓΝ102 | 5.0ΓΝ102 | 6.4ΓΝ101 | y | 2.4ΓΝ101 |
±μ÷–y ΘΫ______ΓΘ