题目内容
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
【答案】B
【解析】试题分析:A、加水促进醋酸的电离,平衡正向移动,A错误;B、加入少量NaOH固体,溶液的酸性减弱,平衡正向移动,B正确;C、加入少量0.1 mol·L-1盐酸,溶液中的c(H+)增大,抑制醋酸电离,C错误;D、加入少量CH3COONa固体时,醋酸根离子浓度增大,平衡逆向移动,D错误。答案选B。

练习册系列答案
相关题目
【题目】生活污水和某些工业废水中的含氮化合物经转化最终会以硝酸盐的形式进入水体,若大量排放会造成水体富营养化。用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如右图所示。
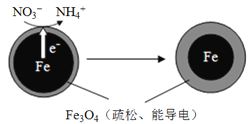
(1)下列说法属于水体污染的危害的有______(填字母)。
a.加剧水资源短缺 b.危害人体健康
(2)NO3-中氮元素的化合价为______。
(3)Fe在反应过程中发生的是______(选填“氧化”或“还原”)反应。
(4)将足量铁粉投入某水体样本中,经一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计)。
离子 | Na+ | H+ | NO3 | NH4+ | Fe2+ |
浓度/(mol·L1) | 5.0×102 | 5.0×102 | 6.4×101 | y | 2.4×101 |
表中y =______。

