题目内容
4.(1)O22+与N2互为等电子体,O22+的电子式可表示为 ; O22+中σ键数目和π键数目之比为1:2.
; O22+中σ键数目和π键数目之比为1:2.(2)将乙炔通入[Cu(NH3)2]Cl溶液生成红棕色沉淀Cu2C2.Cu+基态核外电子排布式为1s22s22p63s23p63d10; Cu+的配位数为2.
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)中C原子杂化类型是sp、sp2.
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则在图示状况下,铁颗粒表面上N/Fe原子数比为1:2.

分析 (1)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键和1个σ键;
(2)根据Cu为29号元素,根据电子排布式的书写方法来解答;根据[Cu(NH3)2]Cl分析;
(3)根据丙烯腈(H2C=CH-C≡N)中的C形成的δ键个数判断;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子.
解答 解:(1)根据等电子体原理可知,O22+的电子式  ,在1个O22+含有2个π键和1个σ键,则O22+中σ键数目和π键数目之为,1:2;
,在1个O22+含有2个π键和1个σ键,则O22+中σ键数目和π键数目之为,1:2;
故答案为: ;1:2;
;1:2;
(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面,同时还有就是它的3d结构,Cu+的基态电子排布式为1s22s22p63s23p63d10,[Cu(NH3)2]Cl中为配体,则配位数为2;
故答案为:1s22s22p63s23p63d10;2;
(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;
故答案为:sp、sp2;
(4)根据氮原子在铁的晶面上的单层附着局部示意图可以看出,每个铁原子周围有2个氮原子,而每个氮原子周围有4个铁原子,所以对于某个氮原子来讲,属于这个氮原子的铁原子数为4×1212=2,所以氮原子与铁原子的个数比为1:2,
故答案为:1:2.
点评 本题考查了学生对等电子体、Cu+基态核外电子排布、原子轨道杂化类型等知识,侧重于考查学生对基础知识的综合应用能力,难度中等,注意把握杂化轨道类型的判断方法.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
14.已知由石墨制备金刚石的反应为:C(石墨)一定条件_C(金刚石);△H>0,则下列两个反应中:C(石墨)+O2(g)═CO2(g);△H=a kJ/mol,C(金刚石)+O2(g)═CO2(g);△H=b kJ/mol,a与b的关系为( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
15.下列物质互为同分异构体的一组是( )
| A. | 35Cl和37Cl | B. | CH3COOH和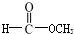 | C. | O2和O3 | D. | CH2=CH2和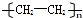 |
12.能正确表示下列反应的离子方程式是( )
| A. | 烧碱溶液中通入过量二氧化硫 2OH-+SO2═SO32-+H2O | |
| B. | 在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液 NH4++H++2OH-═NH3•H2O+H2O | |
| C. | 硫酸铁的酸性溶液中通入足量硫化氢 2Fe3++H2S═2Fe2++S↓+2H+ | |
| D. | 铜与浓硝酸:Cu+2H++2NO3-═Cu2++2NO2↑+H2O |
9.简单原子的原子结构可用如图的表示方法来形象表示,其中“黑球”表示质子或电子,“白球”表示中子.则下列有关①、②、③的叙述中正确的是( )
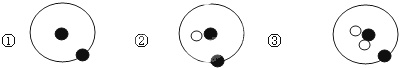

| A. | ①、②、③互为同位素 | B. | ①、②、③互为同素异形体 | ||
| C. | ①、②、③是三种化学性质不同的核素 | D. | ①、②、③质量数相同 |
14.化学键是( )
| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
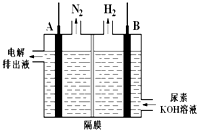
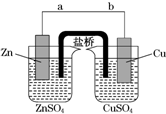 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: