题目内容
14.化学键是( )| A. | 只存在于分子之间 | |
| B. | 是相邻的两个或多个原子或离子之间强烈的相互作用 | |
| C. | 只存在于离子之间 | |
| D. | 是相邻的两个或多个离子之间强烈的静电作用 |
分析 化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,根据定义分析即可.
解答 解:A、化学键通常指的是相邻的两个或多个原子之间强烈的相互作用,化学键既可存在于相邻的原子之间,也可存在于相邻的离子之间,故A错误;
B、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,这种相互作用既包括吸引力也包括排斥力,故B正确;
C、化学键既可存在于相邻的原子之间,也可存在于相邻的离子之间,故C错误;
D、离子键和金属键是静电作用,而共价键是通共用电子形成的相互作用,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握化学键判断的一般规律为解答的关键,注重基础知识的考查,选项D为解答的易错点,题目难度不大.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,44 g C3H8中含有的碳碳单键数为3 NA | |
| C. | 6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
2.某芳香烃的分子式为C9H12,其苯环上一氯代物只有两种同分异构体有几种( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.下列分子中的中心原子的杂化类型为sp2杂化的是( )
| A. | BeCl2 | B. | NH3 | C. | BF3 | D. | H2O |
19.碱金属(如锂、钠、钾、铷等)溶于汞中形成良好的还原剂“汞齐”.取某种碱金属的汞齐7g,与足量水作用得到0.2g氢气,并得到密度为ρ•cm-3的溶液1L,则溶液中溶质的质量分数可能是( )
| A. | ($\frac{0.8}{ρ}$)% | B. | ($\frac{0.48}{ρ}$)% | C. | ($\frac{0.32}{ρ}$)% | D. | ($\frac{0.7}{ρ}$)% |
6.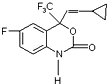 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
3.关于化学反应中的能量变化,下列说法中不正确的是( )
| A. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| B. | 对于可逆反应:aA(g)+bB(g)═bC(g)+dD(g),如果正反应是放热反应,逆反应一定是吸热反应 | |
| C. | 氢气燃烧生成水是一个放热反应,说明1mol H2的能量高于1mol H2O的能量 | |
| D. | 加热才能发生的反应,不一定是吸热反应 |
4.2013年6月11日,我国“神十”载人航天飞船发射取得圆满成功.火箭发射时燃料燃烧的反应为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=akJ/mol,关于此反应的下列说法中正确的是( )
| A. | a>0 | |
| B. | 每生成1mol水,转移8mol电子 | |
| C. | 氧化产物与还原产物的质量比为2:1 | |
| D. | N2H4是氧化剂 |
 ; O22+中σ键数目和π键数目之比为1:2.
; O22+中σ键数目和π键数目之比为1:2.