题目内容
16.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2•L-2,K(35℃)=2.1×10-14 mol2•L-2.则下列叙述不正确的是( )| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
分析 水中存在电离平衡,电离过程是吸热过程,温度升高促进电离,氢离子浓度和氢氧根离子浓度增大;水中氢离子浓度始终等于氢氧根离子浓度,水是中性.
解答 解:A.温度升高促进水的电离,氢离子浓度增大,PH=-lgc(H+),纯水的pH随着温度的升高而降低,故A正确;
B.在35℃时水电离出的氢离子浓度和氢氧根离子浓度比25°C大,但氢离子浓度和氢氧根离子浓度是相同的,水仍是中性,[H+]=[OH-],故B错误;
C.在35℃时水电离出的氢离子浓度和氢氧根离子浓度比25°C大,但氢离子浓度和氢氧根离子浓度是相同的,故C正确;
D.分析不同温度下其平衡常数,K(25℃)=1.0×l0-14,K(35℃)=2.1×l0-14.温度升高平衡常数增大,则水的电离是吸热过程,故D正确;
故选B.
点评 本题考查水的电离平衡的影响因素分析,注意水是中性的液体,氢离子和氢氧根离子浓度相同,题目较简单.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
6.X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
7.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后溶液显示弱酸性,则混合液中微粒浓度关系不正确的为( )
| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
4.下列说法不正确的是( )
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
11.存放食品和药品的包装盒中常可发现一些袋装透明胶状颗粒,该颗粒材料可能的名称及其作用是( )
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |
8. “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端浸有淀粉KI溶液的棉球颜色变化可判断氯气是否被碱液完全吸收 |
6.下列物质属于弱电解质的是( )
| A. | CH3COOH | B. | NaOH | C. | SO2 | D. | NH4Cl |
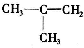 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
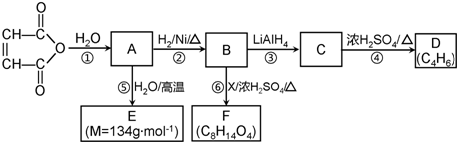

 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.