题目内容
6.下列物质属于弱电解质的是( )| A. | CH3COOH | B. | NaOH | C. | SO2 | D. | NH4Cl |
分析 电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下能自身电离离子导电;部分电离的电解质为弱电解质,完全电离的电解质为强电解质,根据电解质的电离程度划分强弱电解质,弱电解质包括弱酸、弱碱、水与少数盐,据此解答.
解答 解:A.CH3COOH是化合物,在水溶液中是部分电离CH3COOH?CH3COO-+H+,属于弱电解质,故A正确;
B.NaOH属于碱,溶于水或者熔融状态时,可以完全电离变成钠离子和氢氧根离子,属于强电解质,故B错误;
C.二氧化硫溶于水后,和水反应生成亚硫酸,亚硫酸能电离出自由移动的阴阳离子,但电离出阴阳离子的是亚硫酸而不是二氧化硫本身,所以二氧化硫是非电解质,故C错误;
D.氯化铵在水溶液里完全电离,为强电解质,故D错误;
故选A.
点评 本题考查了强弱电解质的判断,根据电解质的电离程度划分强弱电解质,注意不能根据溶液的导电性来划分强弱电解质,为易错点,题目难度不大.

练习册系列答案
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
16.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2•L-2,K(35℃)=2.1×10-14 mol2•L-2.则下列叙述不正确的是( )
| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
14.下列排列顺序不正确的是( )
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
1.为了探究化学反应中的能量变化,某同学设计了如下两个实验.
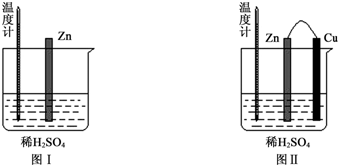
(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
(3)若将图中的Cu片替换为Al片,则Al片上的电极反应式为Al-3e-═Al3.

(1)图Ⅰ中发生反应的离子方程式为Zn+2H+═Zn2++H2↑,实验中温度计指示的温度逐渐升高(填“升高”或“降低”),原因是锌与稀硫酸反应是放热反应.
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释.
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
11.按官能团分类,下列物质与  不同类的是( )
不同类的是( )
 不同类的是( )
不同类的是( )| A. |  | B. |  | C. | CH3CH2OH | D. | CH3OH |
18.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 除去苯中混有的少量苯酚:加入适量浓溴水,振荡、静置后过滤 | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| D. | 检验卤代烃中的卤原子:取足量液体与NaOH溶液共热后,再滴加AgNO3溶液 |
15. T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |

 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+. ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键. ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: