题目内容
6.X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,下列叙述正确的是( )| A. | X的原子序数比Y小 | B. | X原子的最外层电子数比Y大 | ||
| C. | X的原子半径比Y大 | D. | X元素的最高正价比Y大 |
分析 X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,则X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,且X处于第四周期、Y处于第三周期,结合元素周期律解答.
解答 解:X元素的阳离子和Y元素的阴离子都具有与Ar原子相同的电子层结构,则X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,且X处于第四周期、Y处于第三周期.
A.X元素处于Y元素的下一周期,故原子序数X>Y,故A错误;
B.X为金属元素,最外层电子数较少,Y为非金属元素,最外层电子数相对较多,故B错误;
C.X元素处于Y元素的下一周期,X为金属元素,最外层电子数较少,原子半径大于同周期与Y同族的元素,故原子半径X>Y,故C正确;
D.最高正价等于最外层电子数,故X元素的最高正价比Y小,故D错误,
故选C.
点评 本题考查结构位置性质的关系应用,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
17.现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小( )
| A. | O3在水中的溶解度和O2一样 | B. | O3在水中的溶解度比O2小 | ||
| C. | O3在水中的溶解度比O2要大 | D. | 没办法比较 |
14.下列化合中,即有离子键又有共价键的是( )
| A. | H2O | B. | CaO | C. | NaCl | D. | NaOH |
1.某饱和一元醛和饱和一元酮的混合物共0.1mol,质量为5.8g,此混合物和足量的银氨溶液发生银镜反应可析出8.64g银,则该混合物中的醛是( )
| A. | HCHO | B. | CH3CHO | C. | CH3CH2CHO | D. | CH3CH2CH2CHO |
18.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 SO2 | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
16.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14 mol2•L-2,K(35℃)=2.1×10-14 mol2•L-2.则下列叙述不正确的是( )
| A. | 纯水的pH随着温度的升高而降低 | B. | 在35℃时,[H+]>[OH-] | ||
| C. | 在25℃和35℃时,[H+]=[OH-] | D. | 水的电离是吸热的 |
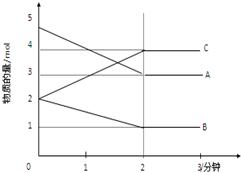 某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体).
某可逆反应在某体积为5L的密闭容器中进行,在从0-3分钟各物质的量的变化情况如图所示(A,B,C均为气体). .
.