题目内容
12.氢氧化铜是一种常用试剂.如:利用新制氢氧化铜验证乙醛的还原性.(1)新制氢氧化铜悬浊液的配制:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡.这样操作的目的是确保NaOH过量.
(2)下面是某研究性学习小组开展的探究性学习活动:
提出问题:对“乙醛与新制氢氧化铜悬浊液反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,进行了如下探究:
提出猜想:红色沉淀可能是Cu或Cu2O或Cu与Cu2O的混合物.
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:
方案1:取该红色沉淀于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硝酸中,观察是否有残渣;
方案3:称取该红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次,直到固体恒重,称得质量为bg,比较a、b的大小;
方案4:取红色沉淀放于大试管里,加入酸化的硝酸银溶液,观察是否有银白色的银析出.
你认为合理的方案是方案3.
(3)质量分数为11.6%的某饱和一元醛水溶液5g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44g.这种醛是丙醛,结构简式为CH3CH2CHO.它与足量新制Cu(OH)2悬浊液反应的化学方程式为CH3CH2CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3CH2COONa+Cu2O↓+3H2O.
分析 (1)新制氢氧化铜悬浊液必须呈碱性,所以配制时NaOH要过量;
(2)Cu和Cu2O都是红色沉淀,所以该红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物;
Cu与Cu2O都能与硝酸反应生成蓝色的硝酸铜溶液,Cu2O与弱氧化性酸反应生成铜盐和Cu单质;Cu与Cu2O都能在空气中加热被氧化生成CuO,所以固体质量都增加,增加的质量不同;
(3)n(Cu2O)=$\frac{1.44g}{144g/mol}$=0.01mol,m(醛)=5g×11.6%=0.58g,如果是甲醛溶液与新制氢氧化铜悬浊液反应,甲醛与Cu2O的关系式是1:2,则甲醛的物质的量是0.05mol,其质量=0.005mol×30g/mol=0.15g<0.58g,所以不是甲醛;
饱和一元醛与新制氢氧化铜悬浊液反应方程式为RCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$RCOONa+Cu2O↓+3H2O,根据方程式知,醛与Cu2O的关系式是1:1,所以醛的物质的量是0.01mol,其摩尔质量=$\frac{0.58g}{0.01mol}$=58g/mol,为丙醛.
解答 解:(1)新制氢氧化铜悬浊液必须呈碱性,所以配制时NaOH要过量,所以这样操作的目的是确保NaOH过量,故答案为:确保NaOH过量;
(2)Cu和Cu2O都是红色沉淀,所以该红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物;
方案1:Cu与Cu2O都能与硝酸反应生成蓝色的硝酸铜溶液,所以根据溶液颜色不能确定红色沉淀成分,故不合理;
方案2:Cu2O和弱氧化性酸反应生成铜盐和Cu单质,但和硝酸反应时即使生成Cu,Cu能与稀硝酸反应生成可溶性的硝酸铜,所以没有沉淀产生,故不合理;
方案3:Cu与Cu2O都能在空气中加热被氧化生成CuO,所以固体质量都增加,增加的质量不同,所以可以根据a、b数值判断红色物质成分,故合理;
方案4:Cu与Cu2O都与稀硝酸生成铜离子,所以不能置换出硝酸银溶液中的Ag,故不合理;
通过以上分析知,只有方案3合理;
故答案为:红色沉淀可能是Cu或Cu2O或Cu与Cu2O的混合物;方案3;
(3)n(Cu2O)=$\frac{1.44g}{144g/mol}$=0.01mol,m(醛)=5g×11.6%=0.58g,如果是甲醛溶液与新制氢氧化铜悬浊液反应,甲醛与Cu2O的关系式是1:2,则甲醛的物质的量是0.05mol,其质量=0.005mol×30g/mol=0.15g<0.58g,所以不是甲醛;
饱和一元醛与新制氢氧化铜悬浊液反应方程式为RCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$RCOONa+Cu2O↓+3H2O,根据方程式知,醛与Cu2O的关系式是1:1,所以醛的物质的量是0.01mol,其摩尔质量=$\frac{0.58g}{0.01mol}$=58g/mol,为丙醛,其结构简式为CH3CH2CHO,丙醛与新制氢氧化铜悬浊液反应方程式为CH3CH2CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3CH2COONa+Cu2O↓+3H2O,
故答案为:丙醛;CH3CH2CHO;CH3CH2CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3CH2COONa+Cu2O↓+3H2O.
点评 本题以丙醛为载体考查探究物质的组成及实验方案评价,为高频考点,明确物质的性质是解本题关键,侧重考查学生分析计算能力,注意Cu与Cu2O性质的相同点和不同点,Cu2O与盐酸或硝酸反应现象不同,注意(3)题排除甲醛的方法,题目难度中等.

| A. | CH4分子的比例模型: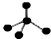 | B. | 乙醇的结构式: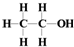 | ||
| C. | CCl4的电子式: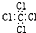 | D. | 乙醛的结构简式:CH3CHO |
| A. | 混合气体的颜色变浅 | B. | 混合气体密度变小 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | N2O4的质量变小 |
| 化学反应 | 反应条件 | |
| A | 由苯制取硝酸苯 | 浓硝酸、加热 |
| B | 由乙醇制取乙烯 | 稀硫酸、170℃ |
| C | 天然蛋白质水解生成α-氨基酸 | 浓硫酸加热 |
| D | 1-溴丁烷生成1-丁烯 | 氢氧化钠、乙醇,加热 |
| A. | A | B. | B | C. | C | D. | D |
 的说法正确的是( )
的说法正确的是( )| A. | 所有原子可能都在同一平面上 | B. | 最多有9个碳原子在同一平面上 | ||
| C. | 只可能有5个碳原子在同一直线上 | D. | 有7个碳原子可能在同一直线上 |
| A. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 |
| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
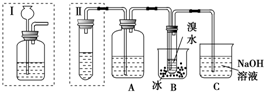
 .
.