题目内容
2.已知甲苯能被酸性KMnO4溶液氧化而使其紫色褪去,但与溴水不反应.现有己烯(液态,性质类似于乙烯)、苯、甲苯三份失去标签的无色液体,有酸性KMnO4溶液、溴水和NaOH溶液三份剂,能将三份无色液体鉴别开来的是( )| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
分析 酸性高锰酸钾溶液能氧化己烯、甲苯,溴水能与己烯发生加成反应,据此解答.
解答 解:A.酸性高锰酸钾溶液能氧化己烯、甲苯而褪色,只用酸性KMnO4溶液不能区别,故A错误;
B.苯、甲苯均可以萃取溴水中的溴,不能鉴别,故B错误;
C.氢氧化钠溶液与己烯、苯、甲苯均分层,且有机层在上层,不能鉴别,故C错误;
D.酸性高锰酸钾溶液能氧化己烯、甲苯,溶液颜色褪去,苯不能使酸性高锰酸钾溶液褪色,溴水能与己烯发生加成反应,溴水颜色褪去,可以进行鉴别,故D正确,
故选D.
点评 本题考查有机物鉴别,比较基础,熟练掌握有机物的性质是固体关键,有利于基础知识的巩固.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
13.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
17.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和NaHCO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
7.下列说法正确的是( )
| A. | 丙氨酸与苯丙氨酸脱水,最多可以生成3种二肽 | |
| B. | 对苯二甲酸(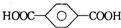 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( 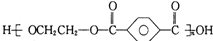 ) ) | |
| C. | 迷迭香酸的结构为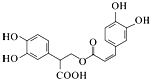 它可以发生酯化、水解、加成、取代、氧化等反应 它可以发生酯化、水解、加成、取代、氧化等反应 | |
| D. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
14.下列说法正确的是( )
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为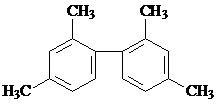 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| B. | 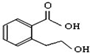 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物为5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
11.表是元素周期表一部分,列出了九种元素在周期表中的位置:
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是K,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).
写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
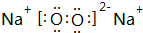
(3)用电子式表示③和⑨形成的化合物的形成过程 .
.
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: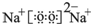 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式F-N=N-F.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
(1)在上述元素中,金属性最强的是K,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).
写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程
 .
.(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:
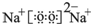 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA(5)表中元素⑥和⑧可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式F-N=N-F.
 .
. .
.