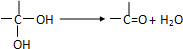
题目内容
3.在一密封的恒容容器P中注入NO2,在25℃时达到平衡状态,若将P置于100℃的水中,则升温过程中,说法正确的是( )| A. | 混合气体的颜色变浅 | B. | 混合气体密度变小 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | N2O4的质量变小 |
分析 可逆反应2NO2?N2O4,正反应放热,升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行,
A、二氧化氮的浓度增大,颜色加深;
B、升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT判断;
C、混合气体总的物质的量增大,根据M=$\frac{m}{n}$判断;
D、可逆反应2NO2?N2O4,正反应放热,升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行分析;
解答 解:升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行.
A、二氧化氮的浓度增大,颜色加深,故A错误;
B、混合气体的温度升高,容器的容积不变,混合气态质量不变,密度不变,故B错误;
C、混合气体总的物质的量增大,混合气体总的质量不变,根据M=$\frac{m}{n}$可知,混合气体的平均相对分子质量减小,故C错误;
D、可逆反应2NO2?N2O4,正反应放热,升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行,N2O4的质量变小,故D正确;
故选D.
点评 本题考查学生温度对化学平衡的影响知识,难度不大,注意根据平衡移动原理理解,掌握基础是关键.

练习册系列答案
相关题目
6.W、X、Y、Z、M、R为6种短周期元素.W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示.
(1)Z元素位于周期表第二周期ⅣA族.
(2)R离子的结构示意图为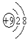 .
.
(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为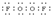 .
.
| Z | M | R | ||
| Y |
(2)R离子的结构示意图为
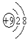 .
.(3)Z、M、R三种元素的简单氢化物中,沸点最高的是H2O(填分子式).
(4)六种元素原子半径从大到小的顺序为Na>Al>C>O>F>H(用元素符号表示).
(5)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
(6)Y4Z3能与M的简单氢化物反应生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为Al4C3+12H2O=4Al(OH)3+3CH4↑.
(7)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为
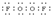 .
.
11.下列物质属于同系物的是( )
| A. |  和 和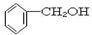 | B. | CH3CH2Cl和CH2ClCH2CH2Cl | ||
| C. | CH3COOH和C17H33COOH | D. | C2H5OH和CH4O |
8.下列叙述正确的是( )
| A. | 元素周期律的本质是原子半径呈周期性变化 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 阳离子的核外电子排布一定比它的原子少一个电子层 | |
| D. | 两原子如果核外电子排布相同,则一定属于同种元素 |
15.下列反应不能引入羟基的是( )
| A. | 还原 | B. | 酯化 | C. | 加成 | D. | 水解 |
13.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |

 .
. .
.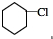 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$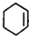 +NaCl+H2O.
+NaCl+H2O. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图.
)的合成路线示意图.