题目内容
4.(1)写出甲醇CH4O的电子式 .
.(2)比较熔点:甲醇>丙烷(填“>”或“<”),原因是甲醇分子间存在氢键.
分析 (1)甲醇为共价化合物,根据其结构式书写;
(2)甲醇分子间含有氢键,丙烷不含有.
解答 解:(1)甲醇为共价化合物,其结构式为 ,每一个短线代表一对电子,则其电子式为:
,每一个短线代表一对电子,则其电子式为: ,
,
故答案为: ;
;
(2)含有氢键的物质相对无氢键的物质,沸点较高,甲醇分子间存在氢键,沸点比丙烷高,
故答案为:>;甲醇分子间存在氢键.
点评 本题考查了电子式的书写、化合物的沸点比较,题目难度不大,注意把握离子电子式的书写方法,注意利用氢键角度来比较沸点.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
15.下列反应不能引入羟基的是( )
| A. | 还原 | B. | 酯化 | C. | 加成 | D. | 水解 |
19.除去下列有机物中的少量杂质,所用试剂和分离方法均正确的是( )
| A. | 乙醇中的水:CaO,蒸馏 | B. | 乙酸乙酯中的乙酸:NaOH溶液,分液 | ||
| C. | 乙醇中的苯酚:溴水,过滤 | D. | 乙烷中的乙烯:溴水,分液 |
16.广东是海洋资源大省,在开发利用海水资源过程中,下列说法不正确的是( )
| A. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| B. | 海水蒸发制海盐的过程是化学变化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
13.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
14.下列说法正确的是( )
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为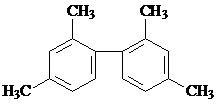 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| B. | 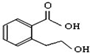 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物为5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
