题目内容
14.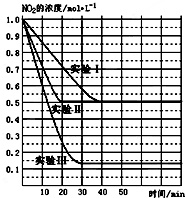 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
分析 (1)①实验Ⅰ和实验Ⅱ平衡时NO2的浓度相同,但实验Ⅱ反应速率大;实验Ⅲ的起始浓度不变,说明压强不变,既要加快反应速率,又要使平衡正向移动,只能是升高温度;
②化学平衡常数为生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值;
③根据平衡常数和浓度商判断平衡移动;
(2)①根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
②化学平衡常数只与温度有关,由于该反应为吸热反应,升温,平衡右移,K增大,v(正)、v(逆)均增大并且正反应速率先增大后减小;
(3)①依据表中平衡常数的数据分析,一水合氨电离程度大于碳酸第一步电离平衡常数,(NH4)2CO3溶液显碱性;
②A、CO32-水解程度大于铵根离子的水解程度,碳酸氢根离子浓度大于一水合氨浓度;
B、溶液中存在电荷守恒分析判断;
C、依据溶液中物料守恒分析;
D、溶液中存在物料守恒,n(N)=2n(C).
解答 解:(1)①对比实验Ⅰ,实验Ⅱ只是加快了反应速率,化学平衡不移动,又该反应前后不是等体积反应,故改变的条件只能是使用催化剂;实验Ⅲ的起始浓度不变,说明压强不变,既要加快反应速率,又要使平衡正向移动,只能是升高温度;故答案为:使用催化剂;升高温度;
②实验Ⅰ中,
即 2NO2(g)?2NO(g)+O2(g)
开始 1mol•L-1 0 0
转化0.5mol•L-1 0.5mol•L-1 0.25mol•L-1
平衡0.5mol•L-1 0.5mol•L-1 0.25mol•L-1
K=$\frac{c{\;}^{2}(NO)•c(O{\;}_{2})}{c{\;}^{2}(NO{\;}_{2})}$=$\frac{0.5{\;}^{2}•0.25}{0.5{\;}^{2}}$=0.25;故答案为:0.25;
③当通入1molNO2与1mol NO混合气体,Qc=$\frac{(0.5+0.5){\;}^{2}×0.25}{(0.5+0.5){\;}^{2}}$=0.25,所以平衡不移动,故答案为:不;
K=$\frac{c{\;}^{2}(NO)•c(O{\;}_{2})}{c{\;}^{2}(NO{\;}_{2})}$=0.25,故答案为:0.25;
③由于平衡时,c(NO)=c(NO2),再各增加1mol,两者浓度还是相等,故QC=K,平衡不移动,故答案为:不;
(2)①平衡标志的简单方法是,给定的量从变到不变了,则反应到达平衡了;
A、反应前后气体体积不变,则压强不能作为标志,故A错误;
B、混合气体的颜色不变了,则c(NO2)不变了,达平衡状态,故B正确;
C、SO3、NO均为生成物,体积比始终不变,则C错误;
D、反应前后质量和物质的量都不变,所以平均相对分子质量始终不变,故D错误;
E、固定体积的容器中,反应前后质量不变,则混合气体的密度始终不变,故E错误;
F、SO2和NO2的起始体积比1:2,变化量之比是1:1,所以当其体积比不变时,反应达到了平衡,故F正确;
故选:BF.
②平衡常数只随温度改变而变,平衡常数变大,说明平衡正向移动了,△H>0,温度升高了,所以在平衡移动时,正反应速率先增大后减小,故选:AB.
(3)①由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),所以(NH4)2CO3溶液呈碱性,故答案为:碱;
②根据由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),且c (HCO3-)>c(NH3•H2O);所以A、CO32-水解程度大于铵根离子的水解程度,碳酸氢根离子浓度大于一水合氨浓度,c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3•H2O),故A正确;
B、溶液中存在电荷守恒,c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2 c(CO32-),故B错误;
C、依据溶液中物料守恒,溶液中碳元素守恒得到,c (CO32-)+c (HCO3-)+c (H2CO3)=0.1 mol•L-1,故C正确;
D、溶液中存在物料守恒,n(N)=2n(C),c (NH4+)+c (NH3•H2O)=2 c (CO32-)+2c (HCO3-)+2 c (H2CO3),故D正确;
故选:ACD.
点评 本题考查图象与化学平衡、平衡状态的判断以及电解质溶液中的离子浓度大小分析,明确影响化学平衡的因素及图象中量以及弱电解质电离程度和盐类水解程度的理解应用,电解质溶液中电荷守恒,物料守恒是解题关键,题目难度中等.

| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 苯酚钠溶液与少量二氧化碳反应:2C6H5O-+CO2+H2O→2 C6H5OH+CO32- | |
| C. | 在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ |
| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
| A. | 实验室用锌与稀硫酸反应时,滴加少量硫酸铜溶液能加快反应速率,因为硫酸铜是催化剂 | |
| B. | 某温度下,一定体积的密闭容器中进行可逆反应:X(g)+Y(g)=Z(g)+W(g)△H>0,平衡后加入一定量X,则△H增大 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.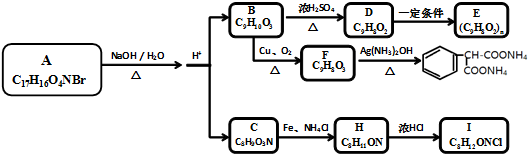
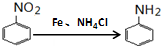
 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.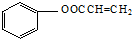 ,
,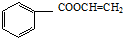 .
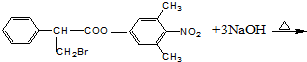
.
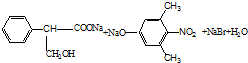 .
.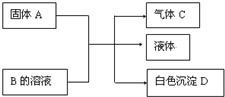 (1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.
(1)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素.它们间的反应关系如图所示.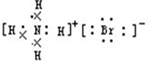 .
.