��Ŀ����
3��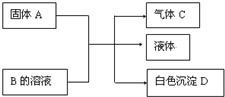 ��1��A��B��C��D��Ϊ��ѧ��ѧ���������ʣ������Ԫ�ؾ�Ϊ����Ԫ�أ����Ǽ�ķ�Ӧ��ϵ��ͼ��ʾ��
��1��A��B��C��D��Ϊ��ѧ��ѧ���������ʣ������Ԫ�ؾ�Ϊ����Ԫ�أ����Ǽ�ķ�Ӧ��ϵ��ͼ��ʾ����A�ǿ�����ǿ�B�����Σ�D������ϡ���ᣬ��A��B��Ӧ�����ȣ��Ļ�ѧ����ʽΪBa��OH��2+��NH4��2SO4$\frac{\underline{\;\;��\;\;}}{\;}$BaSO4��+2NH3��+2H2O��C�����и�ԭ�Ӳ��ܣ��ܻ��ܣ�����8���ӵ��ȶ��ṹ��C���廯�ⷴӦ�����ɵ����ʵĵ���ʽΪ
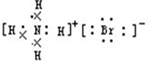 ��
���������£�����ĵ���ƽ�ⳣ��Ϊ2��10-5����������ˮ�ⳣ��Ϊ5��10-10��
��2��A��B��C��D��E��F��G����ԭ��������������Ķ���������Ԫ�أ�A��E������������ͬ������������Ԫ�ص�ԭ���У�Eԭ�ӵİ뾶���D��Fͬ���壬Fԭ�ӵ���������Dԭ����������2����A��D���γ����ֳ�����Һ̬������X��Y����Է�������X��Y����B�γɵĻ�����������࣮�ش����⣺
��GԪ��ΪCl����Ԫ�ط��ţ���
��A��C��D����Ԫ���γɵĻ������кܶ࣬�����ܴٽ�ˮ�ĵ������NH4NO3��дһ�ּ��ɣ�
��Һ̬������Y��ϡH2SO4�ữ��K2Cr2O7��Һ���ÿɲ���һ����ɫ��ȼ�����弰�����Ե�Cr2��SO4��3����÷�Ӧ�����ӷ���ʽΪCr2O72-+3H2O2+8H+=2Cr3++7H2O+3O2����
���� ��1������A�ǿ�����ǿ�B�����Σ����߷�Ӧ�������壬ӦΪ��Σ�D������ϡ���ᣬ��AΪBa��OH��2��BΪ��NH4��2SO4��DΪBaSO4��CΪNH3��
��ˮ��͵���Ϊ������̣�Ka=$\frac{c��C{H}_{3C}O{O}^{{-}_{\;}}����c��H{\;}^{+}��}{c��C{H}_{3}COOH��}$��Kb=$\frac{c��C{{H}_{3}}^{\;}COOH����c��O{H}^{-}��}{c��C{H}_{3}COO{\;}^{-}��}$������Ka•Kb=Kw���ݴ˼��㣻
��2��A��B��C��D��E��F��G����ԭ��������������Ķ���������Ԫ�أ�A��E������������ͬ������������Ԫ�ص�ԭ���У�Eԭ�ӵİ뾶�����EΪNaԪ�أ�D��Fͬ���壬Fԭ�ӵ���������Dԭ����������2������DΪOԪ�أ�FΪSԪ�أ�A��D���γ����ֳ�����Һ̬������X��Y����Է�������X��Y������AΪHԪ�أ�XΪH2O��YΪH2O2��B�γɵĻ�����������࣬��BΪCԪ�أ�C��ԭ����������B��D֮�䣬����CΪNԪ�أ�G��ԭ����������F����GΪClԪ�أ��ݴ˴��⣮
��� �⣺��1������A�ǿ�����ǿ�B�����Σ����߷�Ӧ�������壬ӦΪ��Σ�D������ϡ���ᣬ��AΪBa��OH��2��BΪ��NH4��2SO4��DΪBaSO4��CΪNH3����A��B��Ӧ�����ȣ��Ļ�ѧ����ʽΪ Ba��OH��2+��NH4��2SO4$\frac{\underline{\;\;��\;\;}}{\;}$BaSO4��+2NH3��+2H2O��C������ԭ�ӣ�����C�����и�ԭ�Ӳ�������8���ӵ��ȶ��ṹ��C���廯�ⷴӦ�����ɵ�����ΪNH4Br�������ʽΪ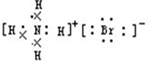 ��
��
�ʴ�Ϊ��Ba��OH��2+��NH4��2SO4$\frac{\underline{\;\;��\;\;}}{\;}$BaSO4��+2NH3��+2H2O�����ܣ�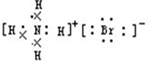 ��
��
��ˮ��͵���Ϊ������̣�Ka=$\frac{c��C{H}_{3C}O{O}^{{-}_{\;}}����c��H{\;}^{+}��}{c��C{H}_{3}COOH��}$��Kb=$\frac{c��C{{H}_{3}}^{\;}COOH����c��O{H}^{-}��}{c��C{H}_{3}COO{\;}^{-}��}$������Ka•Kb=Kw������Kb=$\frac{K{\;}_{w}}{K{\;}_{a}}$=$\frac{1{0}^{-14}}{2��1{0}^{-5}}$=5��10-10��
�ʴ�Ϊ��5��10-10��
��2��A��B��C��D��E��F��G����ԭ��������������Ķ���������Ԫ�أ�A��E������������ͬ������������Ԫ�ص�ԭ���У�Eԭ�ӵİ뾶�����EΪNaԪ�أ�D��Fͬ���壬Fԭ�ӵ���������Dԭ����������2������DΪOԪ�أ�FΪSԪ�أ�A��D���γ����ֳ�����Һ̬������X��Y����Է�������X��Y������AΪHԪ�أ�XΪH2O��YΪH2O2��B�γɵĻ�����������࣬��BΪCԪ�أ�C��ԭ����������B��D֮�䣬����CΪNԪ�أ�G��ԭ����������F����GΪClԪ�أ�
�ٸ�������ķ�����֪��GΪCl���ʴ�Ϊ��Cl��
��A��C��D����Ԫ���γɵĻ��������ܴٽ�ˮ�ĵ����NH4NO3��笠�����ˮ���ܴٽ�ˮ�ĵ��룬�ʴ�Ϊ��NH4NO3��
��YΪH2O2��Y��ϡH2SO4�ữ��K2Cr2O7��Һ���ÿɲ���һ����ɫ��ȼ�����弴Ϊ�����������Ե�Cr2��SO4��3����Ӧ�����ӷ���ʽΪCr2O72-+3H2O2+8H+=2Cr3++7H2O+3O2�����ʴ�Ϊ��Cr2O72-+3H2O2+8H+=2Cr3++7H2O+3O2����
���� ���⿼��������ƶϼ��ṹ��λ�ù�ϵ����Ŀ�Ѷ��еȣ��Ƕ�֪ʶ�ۺ�������ѧ���������飬�ƶ�Ԫ���ǹؼ����Ϻõ�����ѧ�����������Ϣ����֪ʶȫ�����յ������

| A�� | ��ϵͳ������������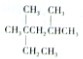 ��������2��4-����-2-�һ����� ��������2��4-����-2-�һ����� | |
| B�� | ��ϩ�ᣨCH2=CH-COOH���ܷ���ȡ���Ӿ����۷�Ӧ | |
| C�� | ���ࡢ��֬�������ʶ��Ǹ߷��ӻ����һ�������¶��ܷ���ˮ�ⷴӦ | |
| D�� | �����ʵ�����HCOOCH3��CH3CHO��ȫȼ�գ������ͨ�������Ĺ������Ʋ���ַ�Ӧ������������ͬ |
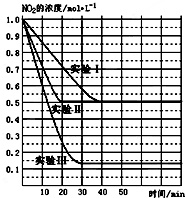 ��1��ij�����£���2L�ܱ������г���NO2�������·�Ӧ��
��1��ij�����£���2L�ܱ������г���NO2�������·�Ӧ��2NO2��g��?2NO��g��+O2��g����H��0���ڲ�ͬ�����£�NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ��
��ش��������⣺
��1��ʵ���ķ�Ӧ�����ֱ���ʹ�ô����������¶ȣ�
��ʵ��������µ�ƽ�ⳣ��K=0.25��
����ʵ����д�ƽ���������ܱ�������ͨ��1molNO2��1mol NO������壨�����¶Ⱥ�������䣩����ƽ�⽫���ƶ������������������
��2��һ��������NO2��SO2�ɷ�����Ӧ���䷽��ʽΪ��NO2��g��+SO2��g��?SO3��g��+NO��g ����H��0����NO2��SO2�������1��2��������̶����ܱ������з���������Ӧ��
��������˵����Ӧ�ﵽƽ��״̬����BF��
A����������ѹǿ���ֲ���
B������������ɫ���ֲ���
C��SO3��NO������ȱ��ֲ���
D����������ƽ����Է����������ֲ���
E�����������ܶȱ��ֲ���
F��SO2��NO2������ȱ��ֲ���
�����ı�������ʹƽ�ⳣ�������÷�ӦAB��
A��һ��������Ӧ�����ƶ�
B����ƽ���ƶ�ʱ������Ӧ������������С
C��һ�����淴Ӧ�����ƶ�
D����ƽ���ƶ�ʱ���淴Ӧ������������С
��3����֪���������ˮ�еĵ���ƽ�ⳣ����25�棩���±���
| ������� | H2CO3 | NH3•H2O |
| ����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | 1.77��10-5 |
������Ϊ����Һ�ʼ��ԣ���ᡱ���С��������
�ھ���Һ������֮�������й�ϵʽ������Ϊ������ȷ����ACD
A��c��NH4+����c��CO32-����c��HCO3-����c��NH3•H2O��
B��c��NH4+��+c��H+��=c��HCO3-��+c��OH-��+c��CO32-��
C��c��CO32-��+c��HCO3-��+c��H2CO3��=0.1mol•L-1
D��c��NH4+��+c��NH3•H2O��=2c��CO32-��+2c��HCO3-��+2c��H2CO3��
| A�� | ��ϵͳ��������������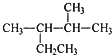 ������Ϊ2-��-3-�һ����� ������Ϊ2-��-3-�һ����� | |
| B�� | �״����Ҵ������ͻ�Ϊͬϵ�� | |
| C�� | �����ʵ�������Ȳ����ȩ��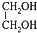 ��ȫȼ��ʱ�ĺ���������� ��ȫȼ��ʱ�ĺ���������� | |
| D�� | ����ϩΪԭ���Ʊ����������ĺϳ�·�߿���Ϊ��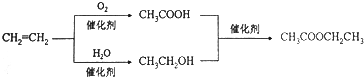 |
| A�� | ������������Դ�Ϳ�������Դ | |
| B�� | ���д�����չ�����ͨ���ٿ�˽�ҳ� | |
| C�� | ���ȼú�����ȼ������ | |
| D�� | ѧУ����ͥ��װ��������װ�� |

| A�� | X��R������ϼ���ͬ | |
| B�� | �����ӵİ뾶��X��Y��Z | |
| C�� | Y��X��R��Ӧ������������ˮ�����֮����Է�����Ӧ | |
| D�� | ������ڵ�X��Z���ɵĻ�������Եõ�����Z |
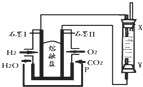 ��H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe��OH��2��װ����ͼ��ʾ������P��ͨ��CO2��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���ǣ�������
��H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe��OH��2��װ����ͼ��ʾ������P��ͨ��CO2��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���ǣ�������| A�� | X��Y���˶������������缫 | |
| B�� | ��������NaOH��Һ��Ϊ���Һ | |
| C�� | ���������ķ�Ӧ�ǣ�2H2O+2e-=H2��+2OH- | |
| D�� | ��ɫ����ֻ���������ϲ��� |
| A�� | ��AgCl�����е��뱥��KI��Һ��Ӧ�����ӷ���ʽ��AgCl+I-=AgI+Cl- | |
| B�� | ��Ba��OH��2��Һ����μ���NH4HSO4��Һ���պó�����ȫ��Ba2++OH-+H++SO42-=BaSO4��+H2O | |
| C�� | ��A1C13��Һ�м�������İ�ˮ��Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D�� | ��Ca��ClO��2��Һ��ͨ������SO2��Ca2++2ClO-+SO2+H2O=CaSO3��+2HClO |
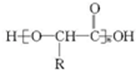
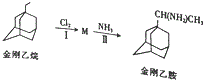 ������顢����Ұ����Ѿ����������ٴ������˸������У����ٴ��о������������Ƚ���Ұ��ĸ�����С��
������顢����Ұ����Ѿ����������ٴ������˸������У����ٴ��о������������Ƚ���Ұ��ĸ�����С��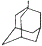 �����������ʾΪR-CH2CH3����
�����������ʾΪR-CH2CH3����
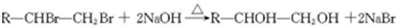 ��
�� ��
�� ��
��