题目内容
2.下列说法正确的是( )| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
分析 A.由H、N、O三种元素形成的化合物中可能只含有共价键、可能含有共价键和离子键;
B.烷烃中,碳原子个数越多其熔沸点越高;
C.蔗糖不含醛基,不能发生银镜反应;
D.铁离子能和KSCN溶液反应生成络合物而使溶液呈血红色.
解答 解:A.H、N、O三种元素形成的化合物中一定有共价键,如硝酸、硝酸铵,故A正确;
B.烷烃中,碳原子个数越多其熔沸点越高,正戊烷、异丁烷和丙烷均属于烷烃的同系物,随碳原子数的减少,沸点降低,故B错误;
C.蔗糖为非还原性糖,不能发生银镜反应,故C错误;
D.KSCN溶液与Fe3+反应的现象为溶液变血红色,故D错误;
故选A.
点评 本题考查化学键、物质熔沸点判断、官能团检验、离子检验等知识点,明确物质结构及性质是解本题关键,知道官能团的检验方法、常见离子的检验方法,题目难度不大.

练习册系列答案
相关题目
12.已知NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,其反应机理为:①2NO=N2O2(快)②N2O2+H2=N2O+H2O(慢)③N2O+H2=N2+H2O(g)(快).下列说法正确的是( )
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
13.下列说法正确的是( )
| A. | 按系统命名法,烷烃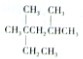 的名称是2,4-二甲基-2-乙基戊烷 的名称是2,4-二甲基-2-乙基戊烷 | |
| B. | 丙烯酸(CH2=CH-COOH)能发生取代加聚缩聚反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下都能发生水解反应 | |
| D. | 等物质的量的HCOOCH3和CH3CHO完全燃烧,产物均通过足量的过氧化钠并充分反应,固体增重相同 |
10.国务院于2011年2月正式批复《浙江海洋经济发展示范区规划》,浙江海洋经济发展示范区建设上升为国家战略.建设好浙江海洋经济发展示范区关系到我国实施海洋发展战略和完善区域发展总体战略的全局.关于海水利用的下列说法不正确的是( )
| A. | 海水有“元素故乡”之称,溴被称为“海洋元素” | |
| B. | 发展氯碱工业是利用海水的一大方向,其中氯气是氧化产物,H2是还原产物 | |
| C. | 工业上从海水中获取NaCl和AlCl3,通过电解其熔融盐可获得金属Na和Al | |
| D. | 利用海水通过物理变化可以获得淡水和食盐,但从海水中获取MgCl2和Br2必须通过化学变化 |
17.25℃,将0.010 0mol•L-1的 NaOH 溶液滴入浓度为0.010 0mol•L-1,体积为20.00mL的 CH3COOH 溶液.在滴加过程中 n(CH3COOH) 和 n(CH3COO-) 随溶液 pH 的分布关系如图.下列说法不正确的是( )
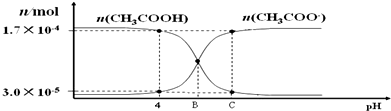

| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
7.在下列条件下,能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
14.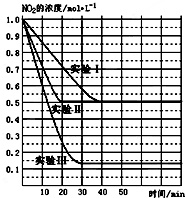 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:
2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液.
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
11.下列说法正确的是( )
| A. | 按系统命名法,化合物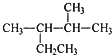 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、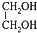 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: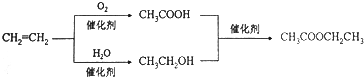 |
12.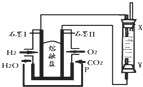 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |