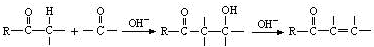题目内容
4.如表是短周期的一部分.关于这四种主族元素,下列说法正确的是( )| X | ||
| M | Y | Z |
| A. | 原子半径大小为Z>Y>M>X | |
| B. | 最高价氧化物的水化物的酸性强弱为X>Z>Y>M | |
| C. | 均形成简单离子,简单离子半径大小为M>Y>Z>X | |
| D. | X、M或Y、M不可能同为金属元素 |
分析 由元素在周期表中位置可知,X处于第二周期,M、Y、Z处于第三周期.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.若W为Al时,则X为C、Y为Si、Z为P,非金属性越强,最高价氧化物对应水化物的酸性越强;
C.若形成简单离子,四种只能为金属元素,M为Na、X为Be、Y为Mg、Z为Al,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.M为Na时,X为Be、Y为Mg,均为金属元素.
解答 解:由元素在周期表中位置可知,X处于第二周期,M、Y、Z处于第三周期.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:M>Y>Z>X,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,若W为Al、X为C、Y为Si、Z为P时,最高价含氧酸的酸性:磷酸>碳酸>硅酸>偏铝酸,故B错误;
C.若形成简单离子,四种只能为金属元素,M为Na、X为Be、Y为Mg、Z为Al,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Na+>Mg2+>Al3+>Be2+,故C正确;
D.M为Na时,X为Be、Y为Mg,均为金属元素,故D错误,
故选C.
点评 本题考查位置与性质关系,需要学生熟练掌握元素周期表,注意元素的不确定性,利用列举法解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.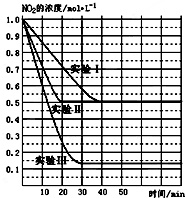 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:
2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液.
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
15.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
12.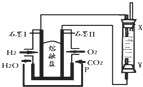 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
9.下列说法正确的是( )
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
16.化学与科技、社会、生活密切相关,下列说法不正确的是( )
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
13.下列解释事实的方程式正确的是( )
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
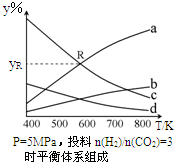 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.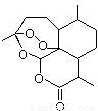
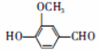 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: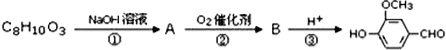
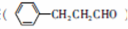 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: