题目内容
19.水杨酸乙酯(分子式C9H10O3)可用于调制日用皂用香精、医药、合成香料,也广泛应用于有机合成和工业溶剂等领域.其同分异构体B有如下的相互转化关系(部分产物省略).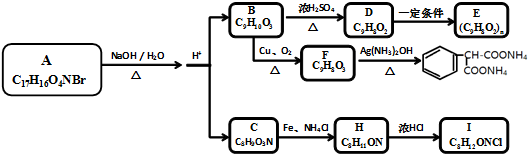
已知:
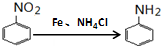
化合物B的苯环上一元取代物有3种.化合物C能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,1molC能与浓溴水中的2molBr2发生反应.
根据以上信息回答下列问题.
(1)下列叙述正确的是BC(填编号).
A.化合物B可直接通过缩聚反应生成E
B.E可以和NaHCO3溶液反应放出CO2气体
C.化合物H在空气中容易被氧化
D.化合物I还能与NaOH溶液反应,但不能发生还原反应
(2)化合物A中不含氧原子的官能团的名称为溴原子,检验该官能团除了需要硝酸银溶液还需要的化学试剂为氢氧化钠溶液、稀硝酸.
(3)化合物D的结构简式是
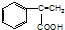 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.(4)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)
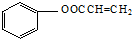 ,
,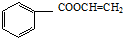 .
.a.属于芳香族化合物 b.属于酯类 c.不能发生银镜反应,能使Br2的CCl4褪色
(5)写出A与足量的氢氧化钠溶液反应的化学方程式
 .
.
分析 由F的分子式C9H8O3及发生银氨溶液反应生成的产物得出F为 ,化合物B的苯环上一元取代物有3种,又B能催化氧化生成醛F,则B为
,化合物B的苯环上一元取代物有3种,又B能催化氧化生成醛F,则B为 ,B在浓硫酸加热条件下发生消去反应生成D,则D为
,B在浓硫酸加热条件下发生消去反应生成D,则D为 ,D在一定条件下发生加聚反应生成高分子E;化合物C能与FeCl3溶液发生显色反应,说明含有酚羟基,分子中含有两个化学环境完全相同的甲基,说明分子对称,又1molC能与浓溴水中的2molBr2发生反应,则苯环羟基的邻对位上有2个氢,则C为
,D在一定条件下发生加聚反应生成高分子E;化合物C能与FeCl3溶液发生显色反应,说明含有酚羟基,分子中含有两个化学环境完全相同的甲基,说明分子对称,又1molC能与浓溴水中的2molBr2发生反应,则苯环羟基的邻对位上有2个氢,则C为 ,根据信息C在Fe、NH4Cl的条件下发生还原反应生成H,则H为
,根据信息C在Fe、NH4Cl的条件下发生还原反应生成H,则H为 ,H与浓盐酸反应生成I,则I为
,H与浓盐酸反应生成I,则I为 ,又A在氢氧化钠的溶液中水解生成B和C,则A为
,又A在氢氧化钠的溶液中水解生成B和C,则A为 ,据此分析解答.
,据此分析解答.
解答 解:由F的分子式C9H8O3及发生银氨溶液反应生成的产物得出F为 ,化合物B的苯环上一元取代物有3种,又B能催化氧化生成醛F,则B为
,化合物B的苯环上一元取代物有3种,又B能催化氧化生成醛F,则B为 ,B在浓硫酸加热条件下发生消去反应生成D,则D为
,B在浓硫酸加热条件下发生消去反应生成D,则D为 ,D在一定条件下发生加聚反应生成高分子E;化合物C能与FeCl3溶液发生显色反应,说明含有酚羟基,分子中含有两个化学环境完全相同的甲基,说明分子对称,又1molC能与浓溴水中的2molBr2发生反应,则苯环羟基的邻对位上有2个氢,则C为
,D在一定条件下发生加聚反应生成高分子E;化合物C能与FeCl3溶液发生显色反应,说明含有酚羟基,分子中含有两个化学环境完全相同的甲基,说明分子对称,又1molC能与浓溴水中的2molBr2发生反应,则苯环羟基的邻对位上有2个氢,则C为 ,根据信息C在Fe、NH4Cl的条件下发生还原反应生成H,则H为
,根据信息C在Fe、NH4Cl的条件下发生还原反应生成H,则H为 ,H与浓盐酸反应生成I,则I为
,H与浓盐酸反应生成I,则I为 ,又A在氢氧化钠的溶液中水解生成B和C,则A为
,又A在氢氧化钠的溶液中水解生成B和C,则A为 ,
,
(1)A.根据以上分析化合物B为 ,可发生缩聚反应生成高分子,而E为
,可发生缩聚反应生成高分子,而E为 在一定条件下发生加聚反应生成的高分子,所以化合物B不可直接通过缩聚反应生成E,故A错误;
在一定条件下发生加聚反应生成的高分子,所以化合物B不可直接通过缩聚反应生成E,故A错误;
B.根据以上分析,EE为 在一定条件下发生加聚反应生成的高分子,其中含有羧基,所以可以和NaHCO3溶液反应放出CO2气体,故B正确;
在一定条件下发生加聚反应生成的高分子,其中含有羧基,所以可以和NaHCO3溶液反应放出CO2气体,故B正确;
C.根据以上分析,H为 含有酚羟基和氨基,所以在空气中容易被氧化,故C正确;
含有酚羟基和氨基,所以在空气中容易被氧化,故C正确;
D.根据以上分析,I为 含有酚羟基可以与NaOH溶液反应,还含有苯环可以与氢气加成,所以也能发生还原反应,故D错误;
含有酚羟基可以与NaOH溶液反应,还含有苯环可以与氢气加成,所以也能发生还原反应,故D错误;
故选:BC;
(2)化合物A为 ,其中不含氧原子的官能团的名称为溴原子,检验该官能团应先在氢氧化钠的水溶液中发生水解反应生成溴离子,再加硝酸调成碱性,最后加硝酸银看是否生成淡黄色沉淀判断是否含溴,所以除了需要硝酸银溶液还需要的化学试剂为氢氧化钠溶液和稀硝酸;故答案为:溴原子;氢氧化钠溶液;稀硝酸;
,其中不含氧原子的官能团的名称为溴原子,检验该官能团应先在氢氧化钠的水溶液中发生水解反应生成溴离子,再加硝酸调成碱性,最后加硝酸银看是否生成淡黄色沉淀判断是否含溴,所以除了需要硝酸银溶液还需要的化学试剂为氢氧化钠溶液和稀硝酸;故答案为:溴原子;氢氧化钠溶液;稀硝酸;
(3)根据以上分析,化合物D的结构简式是 ,C在Fe、NH4Cl的条件下发生还原反应生成H,所以C→H的反应类型是还原反应,故答案为:
,C在Fe、NH4Cl的条件下发生还原反应生成H,所以C→H的反应类型是还原反应,故答案为: ;还原反应;
;还原反应;
(4)D为 a.属于芳香族化合物,含有苯环b.属于酯类,含有酯基c.不能发生银镜反应,能使Br2的CCl4褪色,说明不含醛基,含有碳碳双键,则符合条件的同分异构体
a.属于芳香族化合物,含有苯环b.属于酯类,含有酯基c.不能发生银镜反应,能使Br2的CCl4褪色,说明不含醛基,含有碳碳双键,则符合条件的同分异构体
为: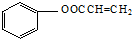 ,
,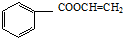 ;故答案为:
;故答案为: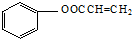 ,
,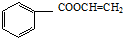 ;
;
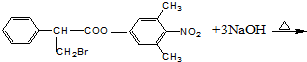
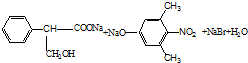
(5)A为 ,与足量的氢氧化钠溶液反应的化学方程式为:
,与足量的氢氧化钠溶液反应的化学方程式为:
 ,故答案为:
,故答案为:
 .
.
点评 本题考查了有机推断,题目难度较大,正确理解题干信息及流程推断原理为解答关键,注意掌握常见有机物结构与性质,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 明矾和漂白粉处理自来水,二者的作用原理相同 | |
| D. | 合成顺丁橡胶( )的单体是CH2=CH-CH=CH2. )的单体是CH2=CH-CH=CH2. |
| A. | 海水有“元素故乡”之称,溴被称为“海洋元素” | |
| B. | 发展氯碱工业是利用海水的一大方向,其中氯气是氧化产物,H2是还原产物 | |
| C. | 工业上从海水中获取NaCl和AlCl3,通过电解其熔融盐可获得金属Na和Al | |
| D. | 利用海水通过物理变化可以获得淡水和食盐,但从海水中获取MgCl2和Br2必须通过化学变化 |
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
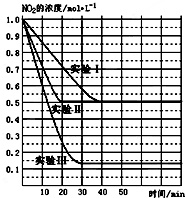 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
| A. | 按系统命名法,化合物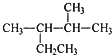 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、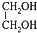 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: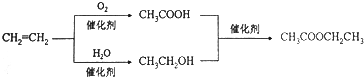 |
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |