题目内容
4. 甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.
甲醇脱氧制取甲醛的原理为CH3OH(g)?HCHO(g)+H2(g),某科研小组在1L恒溶密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示.回答下列问题:
(1)研究表明,该反应的△H>0(填“>”“<”或“=”),能说明该反应达到平衡状态的依据是bc.
a.v(CH3OH)=v(HCHO)
b.H2的浓度不再变化
c.混合气体的平均相对分子质量不再变化
d.混合气体的密度不再变化
(2)T1K时,该反应的平衡常数K=8.1,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)为0.09mol•L-1•s-1,达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,则平衡将向正反应方向(填“正反应方向”或“逆反应方向”)移动,其原因是Qc=$\frac{0.9×(0.9+1.1)}{0.1+1.1}$=1.5<K=8.1.
(3)600K时,Y点甲醇的v(正)<(填“>”“<”或“=”)v(逆),理由是Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动.
(4)已知在25℃、1alm下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-1415.25kJ•mol-1
2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H2=-151.72kJ•mol-1
则CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O(l)△H3=-1263.53kJ•mol-1.
分析 (1)由图可知,温度越高,平衡时甲醇的转化率越大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应;
可逆反应到达平衡时,正逆反应速率相等,各组分的含量、浓度保持不变,由此衍生其它一些物理量不变,注意选择判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
(2)由图可知,T1K时甲醇的转化率为0.9,则参加反应甲醇的物质的量为0.9mol,容器体积为1L,则甲醇的起始浓度为1mol/L,浓度变化量为0.9mol/L,则:
CH3OH(g)?HCHO(g)+H2(g)
开始(mol):1 0 0
转化(mol):0.9 0.9 0.9
平衡(mol):0.1 0.9 0.9
代入平衡常数表达式K=$\frac{c(HCHO)×c({H}_{2})}{c(C{H}_{3}OH)}$计算平衡常数;
根据v=$\frac{△c}{△t}$计算v(HCHO);
达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向;
(3)由图可知,Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动;
(4)由盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也进行相应的计算.
解答 解:(1)由图可知,温度越高,平衡时甲醇的转化率越大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,则△H>0;
a.没有指明正、逆速率,若均为正反应反应速率,二者反应速率始终相等,故a错误;
b.随反应进行氢气的浓度增大,当H2的浓度不再变化时,说明到达平衡,故b正确;
c.混合气体的总质量不变,随反应进行总物质的量增大,故随反应进行平均相对分子质量减小,当平均相对分子质量不再变化时,说明到达平衡,故c正确;
d.混合气体总质量不变,容器体积不变,混合气体的密度始终不变,不能说明到达平衡,故d错误,
故答案为:>;bc;
可逆反应到达平衡时,正逆反应速率相等,各组分的含量、浓度保持不变,由此衍生其它一些物理量不变,注意选择判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
(2)由图可知,T1K时甲醇的转化率为0.9,则参加反应甲醇的物质的量为0.9mol,容器体积为1L,则甲醇的起始浓度为1mol/L,浓度变化量为0.9mol/L,则:
CH3OH(g)?HCHO(g)+H2(g)
开始(mol):1 0 0
转化(mol):0.9 0.9 0.9
平衡(mol):0.1 0.9 0.9
故T1K时,平衡常数K=$\frac{c(HCHO)×c({H}_{2})}{c(C{H}_{3}OH)}$=$\frac{0.9×0.9}{0.1}$8.1,
此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)=$\frac{0.9mol/L}{10s}$=0.09mol/(L.s),
达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,此时的浓度商Qc=$\frac{0.9×(0.9+1.1)}{0.1+1.1}$=1.5<K=8.1,平衡向正反应方向进行,
故答案为:8.1;0.09;正反应方向;Qc=$\frac{0.9×(0.9+1.1)}{0.1+1.1}$=1.5<K=8.1;
(3)由图可知,Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动,则v(正)<v(逆),
故答案为:<;Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动;
(4)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-1415.25kJ•mol-1
②2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H2=-151.72kJ•mol-1
将方程式①-②得CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O(l)△H3=△H1-△H2=-(1415.25-151.72)mol/L=-1263.53mol/L,
故答案为:-1263.53.
点评 本题考查盖斯定律、化学平衡常数计算、平衡状态判断等知识点,侧重考查分析计算能力,知道只有反应前后改变的物理量才能作为平衡状态判断依据,会根据平衡常数与浓度商相对大小判断反应方向,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |
| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 明矾和漂白粉处理自来水,二者的作用原理相同 | |
| D. | 合成顺丁橡胶( )的单体是CH2=CH-CH=CH2. )的单体是CH2=CH-CH=CH2. |
| A. | 按系统命名法,烷烃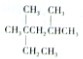 的名称是2,4-二甲基-2-乙基戊烷 的名称是2,4-二甲基-2-乙基戊烷 | |
| B. | 丙烯酸(CH2=CH-COOH)能发生取代加聚缩聚反应 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下都能发生水解反应 | |
| D. | 等物质的量的HCOOCH3和CH3CHO完全燃烧,产物均通过足量的过氧化钠并充分反应,固体增重相同 |
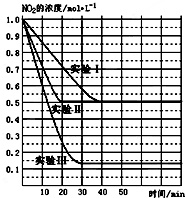 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)

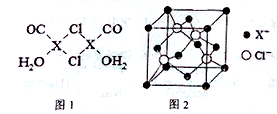 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.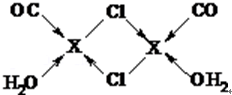 .
.