题目内容
6.下列叙述正确的是( )| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
分析 A、浓H2SO4虽然有强氧化性,常温下不与铜反应;
B、铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜;
C、碳酸的酸性强于次氯酸,应用强酸制弱酸;
D、石英坩埚的成份是二氧化硅,二氧化硅是酸性氧化物.
解答 解:A、浓H2SO4虽然有强氧化性,在加热条件能与Cu发生反应,常温下不反应,故A错误;
B、铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物,故B错误;
C、碳酸的酸性强于次氯酸,所以将CO2通入次氯酸钙溶液可生成次氯酸,故C正确;
D、石英坩埚的成份是二氧化硅,二氧化硅是酸性氧化物,与氢氧化钠反应生成硅酸盐和水,所以不可以将NaOH放入石英坩埚中高温加热,故D错误;
故选C.
点评 本题考查浓硫酸的性质,金属铜的性质,以及酸性的强弱和二氧化硅的性质,注意铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
17.25℃,将0.010 0mol•L-1的 NaOH 溶液滴入浓度为0.010 0mol•L-1,体积为20.00mL的 CH3COOH 溶液.在滴加过程中 n(CH3COOH) 和 n(CH3COO-) 随溶液 pH 的分布关系如图.下列说法不正确的是( )
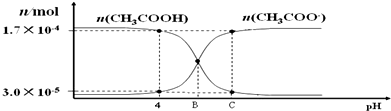

| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
14. (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:
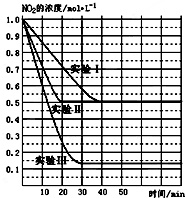
2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液.
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在不同条件下,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.
请回答下列问题:
(1)实验Ⅱ、Ⅲ的反应条件分别是使用催化剂、升高温度.
②实验Ⅰ条件下的平衡常数K=0.25;
③若实验Ⅰ中达平衡后,再向该密闭容器中通入1molNO2与1mol NO混合气体(保持温度和体积不变),则平衡将不移动(填“正向”或“逆向”或“不”);
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)?SO3(g)+NO(g )△H>0,将NO2与SO2以体积比1:2置于体积固定的密闭容器中发生上述反应.
①下列能说明反应达到平衡状态的是BF;
A、混合气体的压强保持不变
B、混合气体的颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
E、混合气体的密度保持不变
F、SO2和NO2的体积比保持不变
②若改变条件,使平衡常数变大,则该反应AB.
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(3)已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
11.下列说法正确的是( )
| A. | 按系统命名法,化合物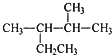 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、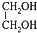 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: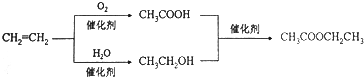 |
15.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
16.化学与科技、社会、生活密切相关,下列说法不正确的是( )
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
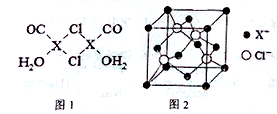 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.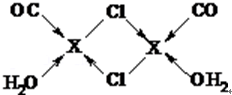 .
.
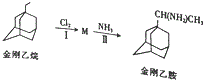 金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.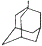 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
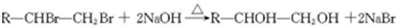 .
.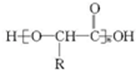 .
.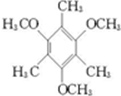 .
.