��Ŀ����
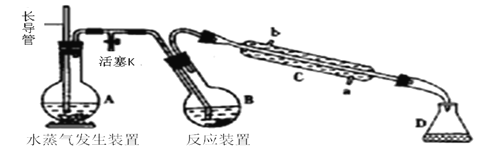
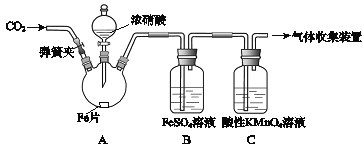
����Ŀ���ס�����ͬѧ����ͼ��ʾװ�ý���ʵ�飬̽������������Ӧ�IJ��
�����أ�
I����Ũ����ͻ��ý�����Ӧ�����У���������Ũ�ȵĽ��ͣ������ɵIJ�����+4��+2����3�۵ȵ��Ļ����
II��FeSO4+NOFe(NO)SO4(��ɫ) ��
III��NO2��NO���ܱ�KMnO4�������ա�
��ʵ������������¼���£�
ʵ����� | ʵ������ |
(1)���ɼУ�ͨ��һ��ʱ��ij���壬�رյ��ɼС� | |
(2)��Һ©����������Ũ���Ỻ��������ƿ�У��رջ����� | ���������� |
(3)������ƿ����Ӧ��ʼ��ֹͣ���ȡ� | ��A���к���ɫ���������һ��ʱ���������ɫ��dz�� B����Һ����ɫ�� C����Һ��ɫ��dz�� �ڷ�Ӧֹͣ��A���й���ʣ�ࡣ |
��ش��������⣺
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������________________��
(2)����Ũ�������ǰû�����������ԭ����__________________________��
(3)��д��������ƿ��A���к���ɫ��������Ļ�ѧ����ʽ_______________��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ�����Ϊ�Ĺ۵����_________(����ȷ�����)�����Ϸ���ʽ����ԭ�� ________________________________��
(5)�����Ƿ����ɩ�3�۵��Ļ����Ӧ���е�ʵ�������________________________��
���𰸡�N2��CO2(�����������̼)�� ����������Ũ�����жۻ� Fe+6HNO3![]() Fe(NO)3+3NO2��+3H2O ���� 3NO2+H2O=2HNO3+NO���÷�Ӧ���ɵ�һ����������FeSO4����ɫ ȡA��Һ���������Թ��У�����Ũ����������Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����ܿڣ���������֤����������Σ�����û���������
Fe(NO)3+3NO2��+3H2O ���� 3NO2+H2O=2HNO3+NO���÷�Ӧ���ɵ�һ����������FeSO4����ɫ ȡA��Һ���������Թ��У�����Ũ����������Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����ܿڣ���������֤����������Σ�����û���������
��������
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ�����������ǵ����������̼��
(2)����ʱ������Ũ�����γ���������Ĥ����ֹ��Ӧ��һ��������
(3)Ũ���������ڼ��������·�Ӧ����������������������ˮ��
(4)����������ˮ��Ӧ���������һ�����������ɵ������ܽ�������������Ϊ������ʹ��Һ��Ϊ��ɫ��ͬʱ�����֪��Ϣ�����ɵ�һ������Ҳ����������������Ӧת��ΪFe(NO)SO4����ɫ��
(5) ����-3�۵��Ļ��������ɣ�Ӧ����NH4+������A��Һ���Ƿ���NH4+���Ӽ��ɡ�
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������N2��CO2(�����������̼)�ȣ�
(2)����ʱ������Ũ���ᷴӦ����һ�����ܵ������ﱡĤ����ֹ������Ũ�����һ����Ӧ���������ۻ��������Ե���Ũ�������ǰû����������
(3)Ũ���������ڼ��������·�Ӧ����������������������ˮ����ѧ����ʽFe+6HNO3![]() Fe(NO)3+3NO2��+3H2O��
Fe(NO)3+3NO2��+3H2O��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ��Ĺ۵����3NO2+H2O=2HNO3+NO�������֪��ϢII���÷�Ӧ���ɵ�һ����������FeSO4����ɫ��
(5)����3�۵��Ļ������ǰ���,������������ˮ���ɰ�ˮ����ˮ��������笠����ӣ�����笠����ӵķ����ǣ�ȡ������Ӧ��A����Һ���Թ��У������м���ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�ӽ��Թܿڣ�����ֽ��������A������NH4+������û��������Ρ�

����Ŀ��Ŀǰ�������ƣ�Na2FeO4�����㷺Ӧ����ˮ�Ĵ��������и�Ч�������ŵ㡣ij�غ�ˮ��Ʒ��Na2FeO4�������������Ӽ���Ũ�ȼ��±���H����OH��Ũ��С��δ�г�����
���� | SO42- | Mg2+ | Fe3+ | Na+ | Cl�� |
Ũ��/(mol��L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
�����£�ȡһ������Na2FeO4�������ĺ�ˮΪԭ���Ʊ�����ʳ��ˮ��MgCl2��7H2O���������£�
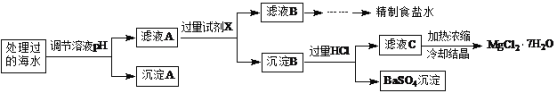
ע�����ӵ�Ũ��С��1.0��10-5 mol��L-1������Ϊ�����Ӳ����ڣ�Ksp[Fe(OH)3]��1.0��10-38��Ksp[Mg(OH)2]��5.0��10-12��������������Һ����ı仯���Բ��ơ�
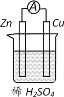
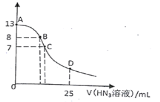
��1�����ݱ����г�������Ũ�ȼ���a��________������A��_______���ѧʽ����
��2���ڵ�����ҺpHʱ��������Ӧ���ڵ�pH��Χ��_______������Ĺ����Լ�XΪ_______���ѧʽ����
��3���������HCl������Ϊ___________��
��4����Fe��������Cu�����������NaOH��Һ���Ƶ�Na2FeO4����������������ĵ缫��ӦʽΪ___________��