题目内容
【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
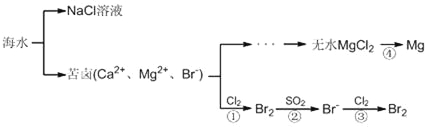
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
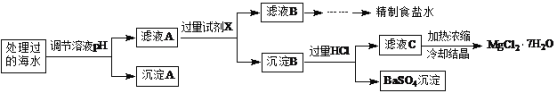
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。
【答案】0.17 Fe(OH)3 3<pH<9 Ba(OH)2 使Mg(OH)2全部转化为MgCl2;抑制Mg2+水解 Fe-6e-+8OH-=FeO42-+4H2O
【解析】
根据电荷守恒计算溶液中离子浓度大小;根据溶度积计算完全沉淀时溶液的pH;根据盐类的水解原理分析易水解盐类的制备流程;根据电解原理书写相关电极方程式。
(1)H+和OH-浓度小,可以忽略,根据表中离子浓度大小,利用电荷守恒可知:2c(SO42-)+c(Cl-)=2c(Mg2+)+3c(Fe3+)+c(Na+),即2a+0.56=2×0.05+3×0.1+0.5,则a=0.17;
由工艺流程图可知,处理的海水调节pH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3;
(2)Mg2+完全沉淀时c(OH-)=10-5mol/L,pH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3,在调节溶液pH时,应当使3<pH<9;由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2;
(3)由工艺流程图可知,加入过量盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,HCl的作用为抑制Mg2+水解;
(4)电解过程中阳极失去电子,发生氧化反应,活泼金属铁作阳极,失去电子,生成FeO42-,电解质溶液为NaOH,则电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。

 阅读快车系列答案
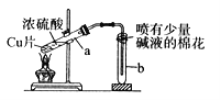
阅读快车系列答案【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
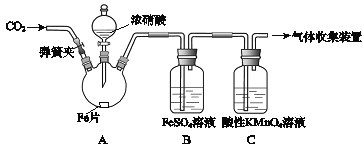
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。