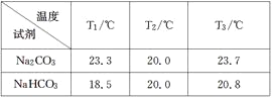
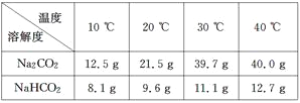
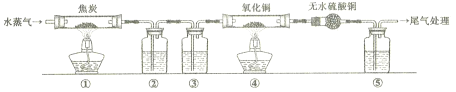
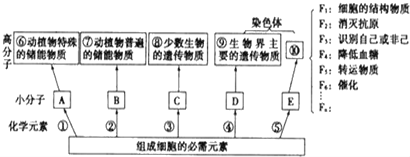
题目内容
【题目】阿伏加德罗常数的值为NA,实验室制备联氨(N2H4)的化学方程式为:2NH3 +NaClO=N2H4 +NaCl+ H2O。下列说法正确的是
A. 0. lmolN2H4中所含质子数为1. 8NA
B. 0. 1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA
C. 消耗4.48LNH3时,转移电子数为0.2NA
D. 1.6g N2H4中存在共价键总数为0.2NA
【答案】A
【解析】分析:A. 1个N2H4中含有(2×7+4×1)=18个质子;B.根据c=![]() 分析判断;C. 气体的体积与温度和压强有关;D.1个N2H4中存在1个N-N键和4个N-H键。
分析判断;C. 气体的体积与温度和压强有关;D.1个N2H4中存在1个N-N键和4个N-H键。
详解:A. 1个N2H4中含有(2×7+4×1)=18个质子,则0. lmolN2H4中所含质子数为1. 8NA,故A正确;B. 未告知0. 1mol·L-1的NaClO溶液的体积,无法计算ClO-的数量,故B错误;C. 为告知气体的状态,无法计算4.48LNH3的物质的量,故C错误;D.1个N2H4中存在1个N-N键和4个N-H键,1.6g N2H4的物质的量=![]() =0.05mol,存在共价键0.05mol×5=0.25mol,故D错误;故选A。
=0.05mol,存在共价键0.05mol×5=0.25mol,故D错误;故选A。

练习册系列答案
相关题目