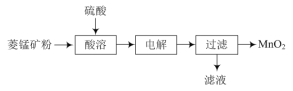
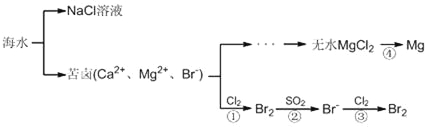
题目内容
【题目】(1)2mol O3和3mo lO2的质量之比为:_____,分子数之比为:_______ ,同温同压下的密度之比为:____________。
(2)现在9 g D2O ,若阿伏加德罗常数的值用NA表示,则:该物质的其物质的量为:______,所含质子数为:_____ , 所含中子数为:__________ 。
【答案】1:1 2:3 3:2 0.45mol 4.5NA 4.5NA
【解析】
(1)根据m=nM计算出氧气和臭氧的质量,再计算出二者质量之比;根据物质的量之比等于分子数之比解答;根据密度与摩尔质量成正比分析;
(2)D2O的相对分子质量为20,分子中含有10个质子、10个中子。
(1)2mol O3和 3mol O2的质量之比为2mol×48g/mol:3mol×32g/mol=1:1,分子数之比为2mol:3mol=2:3,同温同压下的密度之比为48:32=3:2,故答案为:1:1;2:3;3:2;
(2)D2O的相对分子质量为20,分子中含有10个质子、10个中子,9 g D2O的物质的量为![]() =0.45mol,则所含质子数为0.45mol×10×NA/mol =4.5NA,所含中子数为0.45mol×10×NA /mol=4.5NA,故答案为:0.45mol;4.5NA;4.5NA。
=0.45mol,则所含质子数为0.45mol×10×NA/mol =4.5NA,所含中子数为0.45mol×10×NA /mol=4.5NA,故答案为:0.45mol;4.5NA;4.5NA。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
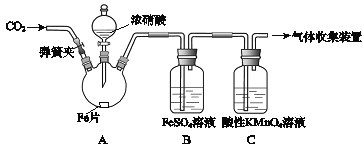
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。