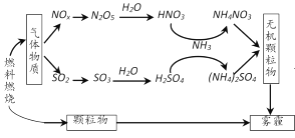
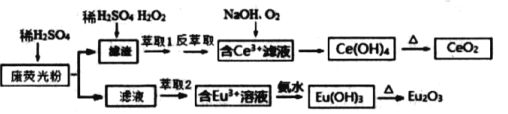
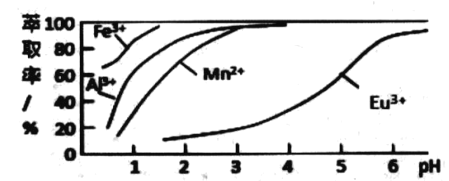
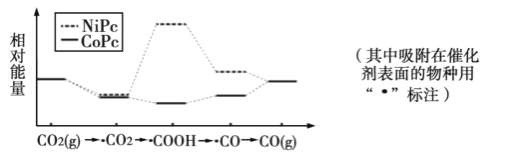
题目内容
【题目】镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
A. 放电时,NiO(OH)作正极
B. 放电时,Cd发生还原反应
C. 电解质溶液为碱性溶液
D. 充电时,阳极反应为Ni(OH)2+OH--e-== NiO(OH)+H2O
【答案】B
【解析】
A.由方程式Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2可知,放电时,Ni元素化合价降低,被还原,在原电池正极上发生还原反应,则NiO(OH)作正极,故A正确;
Cd(OH)2+2Ni(OH)2可知,放电时,Ni元素化合价降低,被还原,在原电池正极上发生还原反应,则NiO(OH)作正极,故A正确;
B.由方程式Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2可知,放电时,Cd元素化合价升高,被氧化,即Cd发生氧化反应,故B错误;
Cd(OH)2+2Ni(OH)2可知,放电时,Cd元素化合价升高,被氧化,即Cd发生氧化反应,故B错误;
C.依据电池反应分析判断,电解质溶液为碱性溶液,故C正确;
D.充电时,阳极失电子,发生氧化反应,反应为Ni(OH)2+OH--e-= NiO(OH)+H2O,故D正确;
故选B。

 能考试期末冲刺卷系列答案
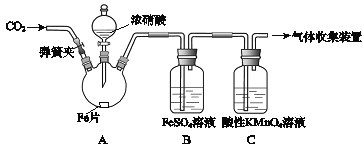
能考试期末冲刺卷系列答案【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。