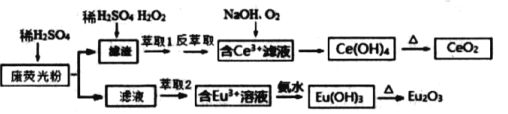
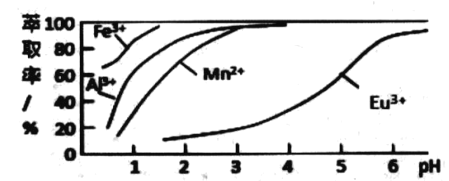
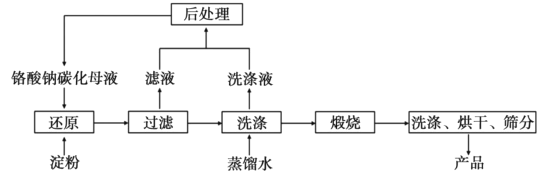
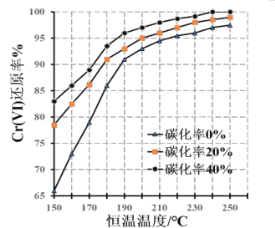
题目内容
【题目】工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释______。
(2)“趁热过滤”时的温度应控制在______。
(3)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:_____________。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行:______,其理由是____________________
【答案】Na2CO3在溶液中存在水解平衡C![]() +H2O
+H2O![]() HC
HC![]() +OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 36 ℃以上 Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1 不可行 若“母液”循环使用,则溶液中c(Cl-)和c(S
+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 36 ℃以上 Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1 不可行 若“母液”循环使用,则溶液中c(Cl-)和c(S![]() )增大,最后所得产物Na2CO3中混有杂质
)增大,最后所得产物Na2CO3中混有杂质
【解析】
根据题中信息可知,工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠,根据简要工艺流程可知:首先将工业碳酸钠溶解于水,然后加入适量的氢氧化钠溶液将Ca2+、Mg2+、Fe3+充分沉淀,过滤后将滤液蒸发浓缩、结晶,趁热过滤后可得到Na2CO3·H2O,将Na2CO3·H2O加热脱水, 得到试剂级碳酸钠。
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠,根据简要工艺流程可知:首先将工业碳酸钠溶解于水,然后加入适量的氢氧化钠溶液将Ca2+、Mg2+、Fe3+充分沉淀,过滤后将滤液蒸发浓缩、结晶,趁热过滤后可得到Na2CO3·H2O,将Na2CO3·H2O加热脱水, 得到试剂级碳酸钠。
(1)Na2CO3在水溶液中可以水解使溶液呈碱性,热的Na2CO3溶液有较强的的碱性,有较强的去油污能力。故答案是:Na2CO3在溶液中存在水解平衡C![]() +H2O
+H2O![]() HC
HC![]() +OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强。
+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强。
(2)由题中信息可知,碳酸钠的饱和溶液在36 ℃以上析出的是流程中所得到的Na2CO3·H2O,故“趁热过滤”时的温度应控制在36 ℃以上。
(3)根据已知的热化学方程式①Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1和②Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1,根据盖斯定律可知,①-②可得Na2CO3·H2O(s)=Na2CO3(s)+H2O(g),故其ΔH=+532.36 kJ· mol-1 -473.63kJ· mol-1=+58.73 kJ·mol-1,故Na2CO3·H2O脱水反应的热化学方程式为Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,这种想法在实际生产中是不可行的,其理由是:若“母液”循环使用,由于Cl-和S![]() 没有转化为沉淀,则溶液中c(Cl-)和c(S
没有转化为沉淀,则溶液中c(Cl-)和c(S![]() )会不断增大,最后所得产物Na2CO3中混有氯化钠和硫酸钠杂质。
)会不断增大,最后所得产物Na2CO3中混有氯化钠和硫酸钠杂质。

 阶梯计算系列答案
阶梯计算系列答案【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
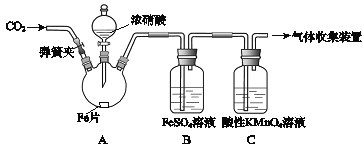
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。
【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
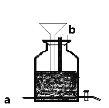
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).