��Ŀ����
����Ŀ��Ϊ�ⶨij��Ʒ�з�Ԫ�ص�����������������ʵ�飬���ø�����(�߷е���)����Ʒ�еķ�Ԫ��ת��Ϊ������(�����Ϊ�ͷе��ᣬ�����ͣ������ǶԲ��������ĸ�ʴ)����ˮ������������ͨ���ζ�������ʵ��װ������ͼ��ʾ������װ��ʡ�ԡ�
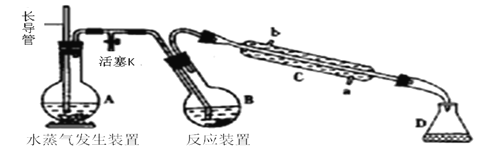
(1) ����C������___________��������������_____________________________��
(2)ʵ��ʱ�����ȴ���K����ˮ����ʱ���رջ���K����ʼ����������ʱ��Ӧװ�þֲ�������ɳ�����ˮλ����������Ӧ����______________________��
(3)����ˮ��������װ�úͷ�Ӧװ��֮��IJ����ܳ�����ʯ��������������________��
(4)B�м���һ������������1.00g ����ϡ��������D��ʢ�еμӷ�̪��NaOH��Һ������A��B��ʹA�в�����ˮ��������B��
���������ʲ��ɴ�����������___________(����)
a. ���� b.���� c.���� d.���� e.����
��D����Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
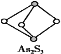
(5)�����Һ�м���25.00mL0.1000mol��L��1La(NO3)3��Һ���õ�LaF3����(La3+������������Ӧ)������0.1000 mol�� L��1EDTA����Һ�ζ�ʣ��La3+(La3+��EDTA��1�U1������Ϸ�Ӧ)������EDTA����Һƽ��19.80mL�������ϡ����Ʒ�з�����������Ϊ______(�ٷ�������С�������λ)��
���𰸡�(ֱ��)������ ƽ����ѹ ����K ���£�����ˮ�������� bde HF+OH��=F��+H2O 2.96%
��������
���ø�����(�߷е���)����Ʒ�еķ�Ԫ��ת��Ϊ������(�����Ϊ�ͷе��ᣬ�����ͣ������ǶԲ��������ĸ�ʴ)����ˮ������������ͨ���ζ�������Ʒ�з�Ԫ�ص�������������ϻ�ѧʵ��Ļ���������ʵ��ԭ���������(1)~(4)��
(5)���ݷ�Ԫ���غ㣬��LaF3~3F���ٸ��ݵζ����̼������ϡ����Ʒ�з�������������
(1)����ͼʾ������CΪ�����ܣ������ܲ���Һ�����£�����Һ���������½�����������ѹǿ�仯��������ˮ�����ݳ����������Ϊƽ��ѹǿ���ʴ�Ϊ�������ܣ�ƽ����ѹ��
(2)ʵ��ʱ�����ȴ���K����ˮ����ʱ���رջ���K����ʼ����������ʱ��Ӧװ�þֲ�������ɳ�����ˮλ����������Ϊ����Һ�������Ӧ����Ӧ����Kƽ��ѹǿ���ʴ�Ϊ������K��
(3)����ˮ��������װ�úͷ�Ӧװ��֮��IJ����ܳ�����ʯ������Ŀ���DZ��£�����ˮ�����������ʴ�Ϊ�����£�����ˮ����������
(4)��B�м���һ������������1.00g����ϡ�����������ø�����(�߷е���)����Ʒ�еķ�Ԫ��ת��Ϊ�����⡣a���������ѻӷ����ᣬ���Դ��棬��a��ѡ��b���������ӷ����ᣬ��bѡ��c���������ѻӷ����ᣬ���Դ��棬��c��ѡ��d�������ǻӷ����ᣬ��dѡ��e.�����ǻӷ����ᣬ��eѡ���ʴ�Ϊ��bde��
��D��ʢ�еμӷ�̪��NaOH��Һ��D�еķ�Ӧ�ǻӷ�����HF������������Һ��Ӧ����Ӧ�����ӷ���ʽ��HF+OH-=F-+H2O���ʴ�Ϊ��HF+OH-=F-+H2O��
(5)���÷�Ԫ���غ㣬��LaF3~3F������ϡ����Ʒ�з�����������=![]() ��100%=2.96%���ʴ�Ϊ��2.96%��
��100%=2.96%���ʴ�Ϊ��2.96%��

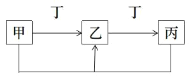
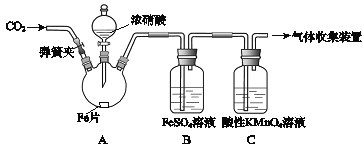
����Ŀ���ס�����ͬѧ����ͼ��ʾװ�ý���ʵ�飬̽������������Ӧ�IJ��
�����أ�
I����Ũ����ͻ��ý�����Ӧ�����У���������Ũ�ȵĽ��ͣ������ɵIJ�����+4��+2����3�۵ȵ��Ļ����
II��FeSO4+NOFe(NO)SO4(��ɫ) ��
III��NO2��NO���ܱ�KMnO4�������ա�
��ʵ������������¼���£�
ʵ����� | ʵ������ |
(1)���ɼУ�ͨ��һ��ʱ��ij���壬�رյ��ɼС� | |
(2)��Һ©����������Ũ���Ỻ��������ƿ�У��رջ����� | ���������� |
(3)������ƿ����Ӧ��ʼ��ֹͣ���ȡ� | ��A���к���ɫ���������һ��ʱ���������ɫ��dz�� B����Һ����ɫ�� C����Һ��ɫ��dz�� �ڷ�Ӧֹͣ��A���й���ʣ�ࡣ |
��ش��������⣺
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������________________��
(2)����Ũ�������ǰû�����������ԭ����__________________________��
(3)��д��������ƿ��A���к���ɫ��������Ļ�ѧ����ʽ_______________��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ�����Ϊ�Ĺ۵����_________(����ȷ�����)�����Ϸ���ʽ����ԭ�� ________________________________��
(5)�����Ƿ����ɩ�3�۵��Ļ����Ӧ���е�ʵ�������________________________��
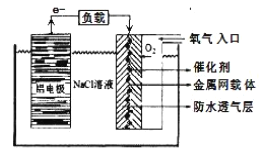
����Ŀ��NaClO��NaNO3��Na2SO3�������ڶ��������ŽϹ��Ӧ�á�
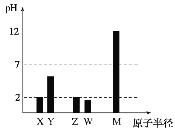
��1���������������漰������Ԫ���У��뾶��С��ԭ����______________��ԭ�Ӻ��������p�Dz��ϵ�������״ֻ̬��һ�ֵ�Ԫ����_____________��
��2�����������£����ۿɳ�ȥ��ҵ��ˮ�е�NaNO2�����������в���һ����ʹʪ���ɫʯ����ֽ���������塣��������Ԫ�صĴ�����ʽ_____________���ѧ���ţ���ÿĦ�����ۿɴ���_____________gNaNO2��
��3���¹����鷢���������õ��ʳ��ˮ����NaClO����Һ��װ����ͼ���缫����ʯī�����缫aӦ����ֱ����Դ��_____________������װ���з����Ļ�ѧ����ʽΪ_____________
��4��Na2SO3��Һ�д���ˮ��ƽ��![]() +H2O
+H2O![]()
![]() +
+![]() ��Ƽ�ʵ��֤����ƽ�����__________________��0.1mol/L Na2SO3��Һ�������ٽ��£������У���Һ����仯���ƣ�PH���¡�
��Ƽ�ʵ��֤����ƽ�����__________________��0.1mol/L Na2SO3��Һ�������ٽ��£������У���Һ����仯���ƣ�PH���¡�
ʱ�� | �� | �� | �� | �� |
�¶�/�� | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
���¹�����PH��С��ԭ����_____________���������ȣ�C(![]() ����____________�ܣ�����>������<����.
����____________�ܣ�����>������<����.