题目内容
19.二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为110℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取并收集ClO2.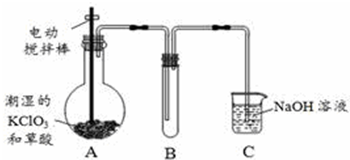
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O.
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、温度计;B装置必须放在冰水浴中,其原因是使ClO2充分冷凝,减少挥发.
(3)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①蒸发浓缩结晶;②趁热过滤;③洗涤;④干燥.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①配制100mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:100mL容量瓶、胶头滴管.
②写出步骤2中发生反应的离子方程式2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
③原ClO2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g/L(用步骤中的字母代数式表示).
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高.
若滴定开始仰视读数,滴定终点时正确读数,则测定结果偏低.(填“偏高”“偏低”或“不变”)
分析 (1)根据反应物、产物和反应条件写出反应方程式;
(2)测量温度的仪器是温度计,二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(4)①根据配制一定物质的量浓度的溶液使用的仪器解答;
②二氧化氯具有氧化性,在酸性环境下,能将碘离子氧化;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
④根据实验操作中滴定液体积大小的影响来回答判断.
解答 解:(1)加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4 $\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4 $\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(2)要控制温度必须使用温度计测量温度,二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,
故答案为:温度计;使ClO2充分冷凝,减少挥发;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,
故答案为:蒸发浓缩结晶;趁热过滤;
(4)①配制100mL溶液用到的仪器有托盘天平、药匙、玻璃棒、胶头滴管、烧杯、100mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②二氧化氯具有氧化性,在酸性环境下,能将碘离子氧化,反应的原理方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2 ~5I2 ~10Na2S2O3
2mol 10mol
$\frac{0.01x×{V}_{1}×1{0}^{-3}}{0.1}$ 1×10-3cV2mol
x=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$;
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则相当于消耗的滴定液的体积偏大,所以测定结果偏大;
若滴定开始仰视读数,滴定终点时正确读数,相当于消耗的滴定液体积偏小,所以结果偏小,
故答案为:偏高;偏小.
点评 本题考查实验方案的设计,题目难度较大,明确物质的性质是解本题关键,试题侧重考查学生分析问题、解决问题的能力,注意掌握化学实验基本操作方法及中和滴定原理.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案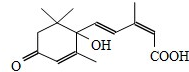 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )| A. | 1mol该分子可与1molNa发生反应产生H2 | |
| B. | 分子中含有两种官能团 | |
| C. | 可发生加成反应和取代反应 | |
| D. | 该分子不能使酸性高锰酸钾溶液褪色 |
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |