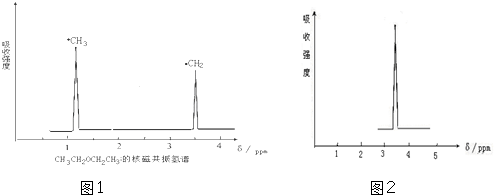
题目内容
2.下列化学用语表示正确的是( )| A. | 氮气的电子式  | |
| B. | Mg2+的结构示意图  | |
| C. | NH3的结构式  | |
| D. | 用电子式表示溴化氢的形成过程为: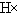 + +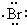 → →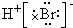 |
分析 A.氮气的电子式中漏掉了氮原子的1对未成键电子;
B.镁离子的核电荷数为12,核外电子总数为10,最外层为8个电子;
C.氨气为共价化合物,分子中含有3个氮氢键,用短线代替共用电子对即为结构式;
D.溴化氢为共价化合物,溴化氢的电子式中不需要标出电荷.
解答 解:A.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为: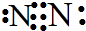 ,故A错误;
,故A错误;
B. 为镁原子,镁离子的核外电子总数为10,镁离子正确的结构示意图为:
为镁原子,镁离子的核外电子总数为10,镁离子正确的结构示意图为: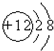 ,故B错误;
,故B错误;
C.氨气分子中含有3个氮氢键,氨气的结构式为: ,故C正确;
,故C正确;
D.溴化氢属于共价化合物,其电子式中不能标出电荷,用电子式表示溴化氢的形成过程为: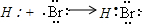 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,明确电子式、离子结构示意图等化学用语的书写原则,试题侧重考查学生的分析能力及规范答题能力.

练习册系列答案
相关题目
12. 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
 将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mo1•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mo1•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27g | |
| B. | 当滴入1mo1•L-1的NaOH溶液85mL时,所得沉淀为Mg(OH)2和Al(OH)3 | |
| C. | 由图可以确定a的取值范围为:0≤a≤50 | |
| D. | 由图可以确定该合金中镁铝物质的量之比0<$\frac{n(Mg)}{n(AI)}$<2.5 |
13.将质量为1g,相同大小的两块铜片分别投入到足量的浓硝酸和稀硝酸中,下列有关说法正确的是( )
| A. | 反应后的溶液的质量相同 | B. | 与浓硝酸的反应中,铜片先消失 | ||
| C. | 产生气体的颜色相同 | D. | 产生气体的体积相同(相同条件) |
10.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物.为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是 C5H8O2. |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3:1. | (3)有机物X的结构简式是 (CH3)2C(CHO)2. |
17.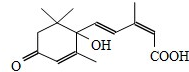 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )| A. | 1mol该分子可与1molNa发生反应产生H2 | |
| B. | 分子中含有两种官能团 | |
| C. | 可发生加成反应和取代反应 | |
| D. | 该分子不能使酸性高锰酸钾溶液褪色 |
7. 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
( )
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
4.有关下列电化学装置说法正确的是( )


| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |