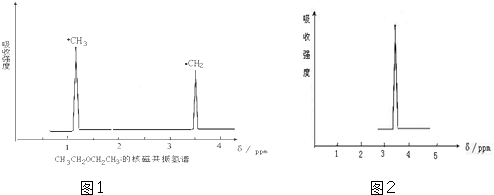
题目内容
16.下列说法错误的是( )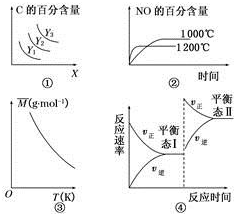
| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
分析 A、根据该反应是一个气体体积增大的吸热反应,当x表示压强时,增大压强,平衡向逆反应方向移动,C的百分含量减小,升高温度,平衡向正反应方向移动,C的百分含量增大,据此分析;
B、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)正反应是放热反应,升高温度,反应速率加快,到达平衡的时间缩短,化学平衡向逆反应方向移动,平衡时NO的含量降低;
C、根据该反应为吸热反应,所以升高温度,平衡向正反应方向移向,结合$\overline{M}=\frac{m(总)}{n(总)}$分析判断;
D、由图可知,该反应从正反应一端开始,正逆反应速率相等时为状态Ⅰ,然后,该反应向正反应方向移动,正反应速率大于逆反应速率,且改变条件的一瞬间逆反应速率也增大,则升温或者增加压强,以此来解答.
解答 解:A.因为该反应是一个气体体积增大的吸热反应,当x表示压强时,增大压强,平衡向逆反应方向移动,C的百分含量减小,符合图象;升高温度,平衡向正反应方向移动,C的百分含量增大,所以温度越高C的百分含量越大,则Y可能表示温度,且Y3>Y2>Y1,故A正确;
B.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故B正确;
C.因为该反应为吸热反应,所以升高温度,平衡向正反应方向移向,当B、C可能均为气体时则正反应为气体体积增大的方向,所以气体物质的量增加,但总质量不变,则根据$\overline{M}=\frac{m(总)}{n(总)}$,平均相对分子质量减小,图象与实际相符合,故C正确;
D.由图可知,该反应从正反应一端开始,正逆反应速率相等时为状态Ⅰ,然后,该反应向正反应方向移动,正反应速率大于逆反应速率,且改变条件的一瞬间逆反应速率也增大,当为改变压强时,则应增大压强,平衡向正反应方向移动,即正反应是一个气体体积减小的反应,故D错误.
故选D.
点评 本题以图象为载体考查了外界条件对化学平衡的影响,难度中等,明确定一议二法分析图象是解题的关键.

| A. | 反应后的溶液的质量相同 | B. | 与浓硝酸的反应中,铜片先消失 | ||
| C. | 产生气体的颜色相同 | D. | 产生气体的体积相同(相同条件) |
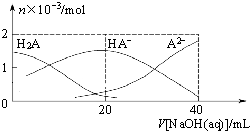 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是( )
| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
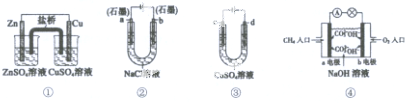
| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
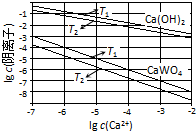 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
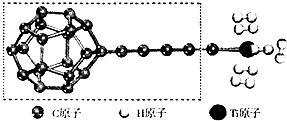 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型有3种.
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心.由钾、镁、氟形成的该化合物的化学式为KMgF3,每个K+与12个F-配位.