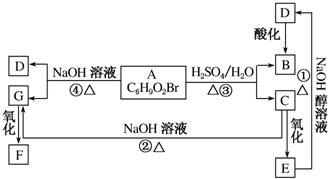
题目内容
11.下列物质的量浓度关系错误的是( )| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |
分析 A.等物质的量浓度、等体积的盐酸和氨水混合,n(HCl)=n(NH3),恰好完全反应生成NH4Cl,为强酸弱碱盐,溶液显酸性,则c(H+)>c(OH-),再结合电荷守恒判断;
B.铵根离子水解程度较小,根据化学式组成可知铵根离子浓度相等时氯化铵溶液的浓度最大;碳酸根离子促进了铵根离子的水解,则c(NH4+)相等时碳酸铵溶液的浓度比硫酸铵的浓度稍大;
C.等浓度、等体积的醋酸钠和醋酸的混合液中,醋酸的电离程度大于醋酸根离子的水解程度,c(CH3COO-)>c(CH3COOH),再结合电荷守恒判断;
D.常温下pH=8的溶液中c(H+)=1×10-8mol•L-1,c(OH-)=1×10-6mol•L-1,再结合电荷守恒进行计算.
解答 解:A.等物质的量浓度、等体积的盐酸和氨水混合,n(HCl)=n(NH3),恰好完全反应生成NH4Cl,为强酸弱碱盐,溶液显酸性,则c(H+)>c(OH-),再结合电荷守恒可知:c(Cl-)>c(NH4+),在溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A正确;
B.c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,氯化铵的化学式中只含有1个铵根离子,则其浓度最大;碳酸根离子促进了铵根离子的水解,则(NH4)2CO3溶液浓度大于(NH4)2SO4溶液,即:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl],故B正确;
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,由于醋酸的电离程度大于醋酸根离子的水解程度,则:c(CH3COO-)>c(CH3COOH),根据电荷守恒c(Na+)+c(OH-)=c(H+)+c(CH3COO-)可知:c(Na+)+c(OH-)>c(H+)+c(CH3COOH),故C错误;
D.常温下NaB溶液的pH=8,溶液中c(H+)=1×10-8mol•L-1、c(OH-)=1×10-6mol•L-1,结合电荷守恒可知:c(Na+)-c(B-)=c(OH-)-c(H+)=9.9×10-7mol•L-1,故D正确;
故选C.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

| A. | 一定互为同系物 | B. | 一定互为同分异构体 | ||
| C. | 碳氢原子最简单整数比相同 | D. | 只能是同种物质 |
| A. | 对肾功能衰竭病人进行“血液透析” | |
| B. | 用热的纯碱溶液清除餐具上沾有的油污 | |
| C. | 常温下用铝罐贮藏贮运浓硫酸 | |
| D. | 对石油进行分馏,裂化获得汽油 |
| A. | C | B. | N | C. | Si | D. | P |
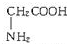 、丙氨酸
、丙氨酸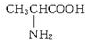 、半胱氨酸
、半胱氨酸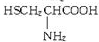 三种氨基酸.现称取该多肽830g,完全水解后共得到1010g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,问:
三种氨基酸.现称取该多肽830g,完全水解后共得到1010g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,问: