题目内容
6.8.0g铁和镁的混合物放入过量的盐酸中,产生标准状况下H2 4.48L,(1)写出该过程中的产生H2的离子方程式:Mg+2H+=Mg2++H2↑、Fe+2H+=Fe2++H2↑
(2)该混合物中铁和镁的物质的量各是多少?(写出计算过程)
分析 (1)Mg和稀盐酸反应生成氯化镁和氢气,Fe和稀盐酸反应生成氯化亚铁和氢气;
(2)利用金属的质量和氢气的体积列方程组计算得出各物质的物质的量.
解答 解:(1)Mg和稀盐酸反应生成氯化镁和氢气,Fe和稀盐酸反应生成氯化亚铁和氢气,离子方程式分别为Mg+2H+=Mg2++H2↑、Fe+2H+=Fe2++H2↑,
故答案为:Mg+2H+=Mg2++H2↑、Fe+2H+=Fe2++H2↑;
(2)设Fe、Mg的物质的量分别是xmol、ymol,根据方程式知,xmolFe完全反应放出氢气的体积为22.4xL、ymolMg完全反应放出氢气体积为22.4yL,根据金属质量和氢气体积列方程组为:
$\left\{\begin{array}{l}{56x+24y=8.0}\\{22.4x+22.4y=4.48}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,
所以Fe、Mg的物质的量都是0.1mol,
答:Fe、Mg的物质的量都是0.1mol.
点评 本题考查混合物的计算及离子方程式的书写,侧重考查学生分析计算能力及对离子方程式的书写规则的掌握,(2)题还可以根据转移电子守恒进行计算,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
16.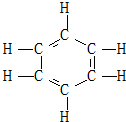 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
①苯不能使溴的CCl4溶液褪色;②苯能与H2发生加成反应
③溴苯没有同分异构体 ④邻二溴苯只有一种.
 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )①苯不能使溴的CCl4溶液褪色;②苯能与H2发生加成反应
③溴苯没有同分异构体 ④邻二溴苯只有一种.
| A. | ①④ | B. | ④ | C. | ②③ | D. | ② |
17.设NA为阿佛加德罗常数,下列说法不正确的是(相对原子质量 Na:23 O:16 H:1)( )
| A. | 78gNa2O2固体中含有的阴离子数为2NA | |
| B. | 18g水中含有的电子数为10NA | |
| C. | 常温常压下,金属钠从水中置换出22.4LH2,发生转移的电子数小于2NA | |
| D. | 在1L2mol/L的硝酸铝溶液中含有的铝离子数为2NA |
14.将锌片和铜片用导线连接置于同一稀硫酸中组成原电池,下列叙述不正确的是( )
| A. | 锌片发生氧化反应 | B. | 铜片发生还原反应 | ||
| C. | 铜片上有氢气析出 | D. | 电子从锌片流出,流向铜片 |
1.下列关于有机化合物的说法正确的是( )
| A. | 由甲烷的氯代物有4种,可推知乙烷的氯代物有6种 | |
| B. | 乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气 | |
| C. | 淀粉、油脂、蔗糖在一定条件下都能发生水解 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
11.下列物质的量浓度关系错误的是( )
| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |
18.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 离子化合物中只含有离子键 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子键一定存在于化合物中 |
9.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
10.下表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:
(1)在这些元素中,(用元素符号填写,下同)金属性最强的元素是Na;非金属性最强的是Cl;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是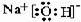 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.
(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为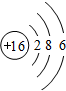 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是
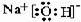 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为
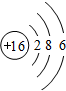 .
.