题目内容
14.化学与生活、生产密切相关,下列过程没有发生化学反应的是( )| A. | 对肾功能衰竭病人进行“血液透析” | |
| B. | 用热的纯碱溶液清除餐具上沾有的油污 | |
| C. | 常温下用铝罐贮藏贮运浓硫酸 | |
| D. | 对石油进行分馏,裂化获得汽油 |
分析 A.血液是胶体;
B.碳酸钠溶液显碱性,能用于清洗油污;
C.常温下浓硫酸能使铝表面形成致密氧化膜,发生钝化;
D.裂化是含碳原子较多,沸点较高的烃断裂为含碳原子较少,沸点较低的烃的过程.
解答 解:A.血液是胶体,透析是利用了胶粒不能透过半透膜,没生成新物质,是物理变化,故A正确;
B.碳酸钠溶液水解显碱性,加热促进水解,减小增强,油脂在碱性溶液中水解生成溶于水的物质,所以能用于清洗油污,是化学变化,故B错误;
C.常温下浓硫酸能使铝表面形成致密氧化膜,发生钝化,发生化学变化,故C错误;
D.裂化是含碳原子较多,沸点较高的烃断裂为含碳原子较少,沸点较低的烃的过程,主要目的是获得轻质油,属于化学变化过程,故D错误.
故选A.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
10.阳离子X2+含中子N个,X的质量数为A,则a g X的同价氧化物中含质子的物质的量是( )
| A. | $\frac{a}{N}$(N-a)mol | B. | $\frac{a}{A+16}$(A-N+10)mol | C. | $\frac{a}{A+8}$(N+n)mol | D. | $\frac{a}{A+16}$(A-N+8)mol |
11.下列物质的量浓度关系错误的是( )
| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |
2.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:A>B>D>C | B. | 原子的最外层电子数目:A>B>D>C | ||
| C. | 原子序数:d>c>b>a | D. | 离子半径:C2->D->B+>A2+ |
9.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
3.根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | MnO4-… | Cl2、Mn2+… |
| ③ | Cl2、FeBr2 | FeCl3、FeBr3 |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第②组反应中生成lmol Cl2,转移电子5mol | |
| C. | 第③组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
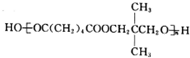
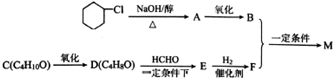
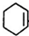 +Br2→
+Br2→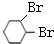 .
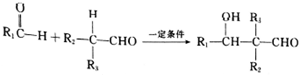
.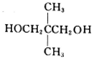 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$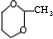 或
或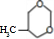 .
.