题目内容
2.油脂是高级脂肪酸甘油酯,将某油脂22.25克进行皂化消耗苛性钠3克,这种油脂的摩尔质量是多少?假定这种油脂是同种链状饱和脂肪酸甘油酯,则该油脂的结构简式是什么?分析 油脂与氢氧化钠按物质的量1:3反应,计算氢氧化钠的物质的量,进而计算该油脂的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,据此确定其相对分子质量;结合油脂是同种链状饱和脂肪酸甘油酯,利用通式及相对分子质量计算.
解答 解:3g氢氧化钠的物质的量为$\frac{3g}{40g/mol}$=0.075mol,
油脂与氢氧化钠按物质的量1:3反应,故油脂的物质的量为$\frac{0.075mol}{3}$=0.025mol,
该油脂的摩尔质量为$\frac{22.25g}{0.025mol}$=890g/mol,故其相对分子质量为890,
饱和脂肪酸的通式为:CxH2x+1COOCH2-CH(CxH2x+1COO)-CH2(CxH2x+1COO),相对分子质量为42x+175,
42x+175=890,解得x=17,可知脂肪酸为C17H35COOH,
油脂的结构简式为C17H35COOCH2-CH(C17H35COO)-CH2(C17H35COO).
答:这种油脂的相对分子质量是890;该油脂的结构简式是C17H35COOCH2-CH(C17H35COO)-CH2(C17H35COO).
点评 本题考查有机物反应的计算,为高频考点,把握油脂在碱性条件下水解的规律及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
12.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )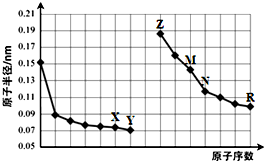

| A. | X、R两种元素的气态氢化物的稳定性:R>X | |
| B. | 简单离子的半径:Y>Z>M | |
| C. | N的单质能与Z的最高价氧化物对应的水化物反应 | |
| D. | Z与X两种元素形成的化合物都是碱性氧化物 |
13.下列离子方程式书写正确的是( )
| A. | 硅酸钠溶液中逐滴加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na2+ | |
| B. | 向氢氧化钠溶液中加入醋酸溶液:OH-+H+=H2O | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
10.阳离子X2+含中子N个,X的质量数为A,则a g X的同价氧化物中含质子的物质的量是( )
| A. | $\frac{a}{N}$(N-a)mol | B. | $\frac{a}{A+16}$(A-N+10)mol | C. | $\frac{a}{A+8}$(N+n)mol | D. | $\frac{a}{A+16}$(A-N+8)mol |
17.设NA为阿佛加德罗常数,下列说法不正确的是(相对原子质量 Na:23 O:16 H:1)( )
| A. | 78gNa2O2固体中含有的阴离子数为2NA | |
| B. | 18g水中含有的电子数为10NA | |
| C. | 常温常压下,金属钠从水中置换出22.4LH2,发生转移的电子数小于2NA | |
| D. | 在1L2mol/L的硝酸铝溶液中含有的铝离子数为2NA |
7.设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A. | 16g的CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1 NaCl溶液中含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA |
14.将锌片和铜片用导线连接置于同一稀硫酸中组成原电池,下列叙述不正确的是( )
| A. | 锌片发生氧化反应 | B. | 铜片发生还原反应 | ||
| C. | 铜片上有氢气析出 | D. | 电子从锌片流出,流向铜片 |
11.下列物质的量浓度关系错误的是( )
| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |