题目内容
15.某元素R的最高价氧化物的化学式为RO2,且R的气态氢化物中氢的质量分数为25%,此元素是( )| A. | C | B. | N | C. | Si | D. | P |
分析 元素R的最高价氧化物化学式为RO2,则X元素最高价为+4价,故气态氢化物RH4,根据氢化物中H元素的质量分数求出R的相对原子质量,据此确定R为何元素.
解答 解:元素R的最高价氧化物化学式为RO2,则X元素最高价为+4价,故气态氢化物RH4,R的气态氢化物中氢的质量分数为25%,则RH4的相对分子质量为:$\frac{4}{25%}$=16,则R的相对原子质量为:16-4=12,则R为C元素,故选A.
点评 本题考查原子结构与元素性质、化学式中元素质量分数的有关计算等,有利于基础知识的巩固.

练习册系列答案
相关题目
11.下列物质的量浓度关系错误的是( )
| A. | 等物质的量浓度的氨水与盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | c(NH4+)相等(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c[NH4Cl] | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(Na+)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 |
3.根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | MnO4-… | Cl2、Mn2+… |
| ③ | Cl2、FeBr2 | FeCl3、FeBr3 |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第②组反应中生成lmol Cl2,转移电子5mol | |
| C. | 第③组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
10.下表是元素周期表的一部分,针对表中的①~⑦种元素,填写下列空白:
(1)在这些元素中,(用元素符号填写,下同)金属性最强的元素是Na;非金属性最强的是Cl;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是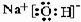 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.
(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是
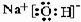 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为
 .
.
20.在一定条件下的密闭容器中,一定能说明反应X(g)+3Y(g)?2Z(g)+2W(g)达到平衡状态的是( )
| A. | Y的浓度不随时间而发生变化 | B. | 反应体系的总压强恒定 | ||
| C. | c(X):c(Y)=1:3 | D. | 每生成3mol的Y同时生成lmol的X |
7.下列各组物质中,互为同系物的是( )
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 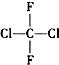 和 和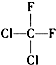 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
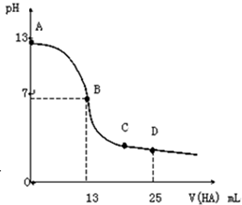 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: