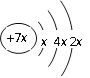题目内容
【题目】NA代表阿伏伽德罗常数的值,下列说法正确的是
A. 2.8 g铁与0.05 mol Cl2充分反应,转移0.15NA电子
B. 27 g Al与足量NaOH溶液反应生成33.6 L H2
C. 14 g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 300 mL 0.2 mol/L蔗糖溶液中所含分子数为0.06NA
【答案】C
【解析】
A. 已知2Fe+3Cl2![]() 2FeCl3,2.8g铁与0.05molCl2充分反应,氯气不足量,铁过量,即氯气完全反应,应转移0.1NA电子,A错误;B. 27gAl与足量NaOH溶液反应生成氢气在标准状况下的体积是33.6L,B错误;C. 乙烯(C2H4)和丙烯(C3H6)的最简式相同即CH2,14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中所含CH2的物质的量为1mol(14g/14g/mol),则混合物中所含有原子的数目为3NA,正确;D. 300mL0.2mol/L蔗糖溶液中所含蔗糖分子数为0.06NA,未包括溶剂水的分子数,D错误。答案选C。
2FeCl3,2.8g铁与0.05molCl2充分反应,氯气不足量,铁过量,即氯气完全反应,应转移0.1NA电子,A错误;B. 27gAl与足量NaOH溶液反应生成氢气在标准状况下的体积是33.6L,B错误;C. 乙烯(C2H4)和丙烯(C3H6)的最简式相同即CH2,14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中所含CH2的物质的量为1mol(14g/14g/mol),则混合物中所含有原子的数目为3NA,正确;D. 300mL0.2mol/L蔗糖溶液中所含蔗糖分子数为0.06NA,未包括溶剂水的分子数,D错误。答案选C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】党的十九大报告提出“加快生态文明体制改革,建设美丽中国”,发展清洁能源对建设美丽中国具有重要意义。氢能是一种高效清洁、极具发展潜力的能源。
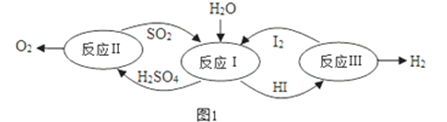
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图1所示:
①反应Ⅰ的离子方程式是______________________________________________;反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层。经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是 _______________________ 。
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+ 2H2O(g)△H = +550kJmo1-1,它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+ H2O(g)△H = +177kJmo1-1,ⅱ.SO3(g)分解,写出SO3(g)分解的热化学方程式 ______________________________。
(2)工业上利用反应C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 2 | 4 | 3.2 |
乙 | 1 | T2 | 1 | 2 | 1.2 |
①T1℃时,该反应的平衡常数K= ______ ;T1 ______ T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量浓度 ______(填选项字母)。
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
(3)工业上还可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,
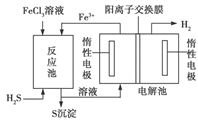
①反应池中反应物的流向采用气、液逆流方式,其目的是____________________;
②反应池中发生反应后的溶液进入电解池,电解总反应的离子方程式为_____________。