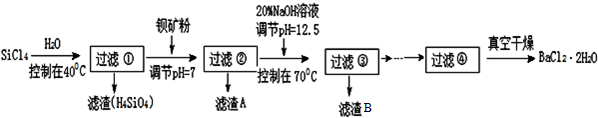
题目内容
6.当前我国环境状况不荣乐观,其中PM2.5、CO、SO2、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义,请回答下列问题:(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
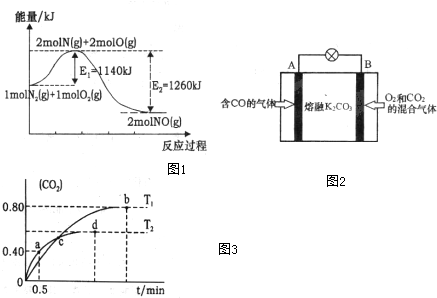
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)
分析 (1)根据溶液中电荷守恒计算;
(2)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②尾气处理主要把NOX与CO转化为无毒物质,五毒物质即氮气和二氧化碳;
③根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行;
④为燃料电池,氧气在正极得到电子,据此书写电极反应方程式;
(3)①根据b点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T1时化学平衡常数K;
②A、因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B、由于T2首先出现拐点,故温度T2>T1,温度越高,二氧化碳体积分数越少,说明此反应为放热反应;
C、此反应特点为前后气体体积不变的反应,据此解答即可;
D、b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
解答 解:(1)溶液中电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)+c(OH-)和KW,得c(H+)=1×10-4mol•L-1,pH值为4,故答案为:4;
(2)①该反应中的反应热=反应物的键能和-生成物的键能和=1140-1260=-120kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1;故答案为:N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1;
②在催化剂作用下NOX与CO反应生成无毒的CO2和N2,2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2,故答案为:2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2;
③根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行,2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,故答案为:不能;该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0;
④此电池中电解质为熔融碳酸钾,正极通入的是氧气与二氧化碳的混合气体,发生反应为:O2+2CO2+4e-=2CO32-,原电池中阴离子在电解质中充当电子移向原电池的负极,故答案为:O2+2CO2+4e-=2CO32-;A;
(3)①T1时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{4}$=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1
T1时化学平衡常数K=$\frac{c(C{O}_{2})^{5}}{c(CO)^{5}}$=$\frac{1.{6}^{5}}{0.{4}^{5}}$=1024,
故答案为:1024;
②A、因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故A正确;
B、由于T2首先出现拐点,故温度T2>T1,温度越高,二氧化碳体积分数越少,说明此反应为放热反应,故△H<0,故B错误;
C、C、此反应特点为前后气体体积不变的反应,再加入2molCO,再次平衡后,CO2的含量不变,故C错误;
D、b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,即K(T1)>K(T2)故D正确,
故答案为:AD.
点评 本题考查热化学反应方程式计算、化学平衡常数的相关计算、化学平衡移动原理,综合性很强,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |
| A. | 除去苯中混有少量的苯酚可加人浓溴水后过滤 | |
| B. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液裉色,说明维生素C具有还原性 | |
| C. | 在淀粉溶液中加稀硫酸并加热后,加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 将Na2SO3溶液蒸干,灼烧至恒重,最终剩余固体是Na2SO3 |
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
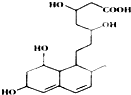
| A. | 含有两种官能团 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
| A. | 纯碱溶液可以清洗油污的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 在强碱溶液中NaClO与Fe(OH)3反应制备Na2FeO4:3ClO-+2Fe(OH)3+4OH?=2FeO42-+3Cl-+5H2O | |
| C. | 铜制品表面的水膜酸性较强时,发生电化学腐蚀,正极反应为2H++2e-=H2↑ | |
| D. | 向AgNO3溶液中加过量NaCl后再加Na2S溶液,白色沉淀变黑色 2Ag++S2-=Ag2S↓ |
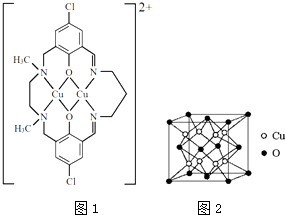 铜是应用较为广泛的有色金属.
铜是应用较为广泛的有色金属.